Зрительный пигмент какой витамин
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 27 марта 2019;
проверки требуют 2 правки.
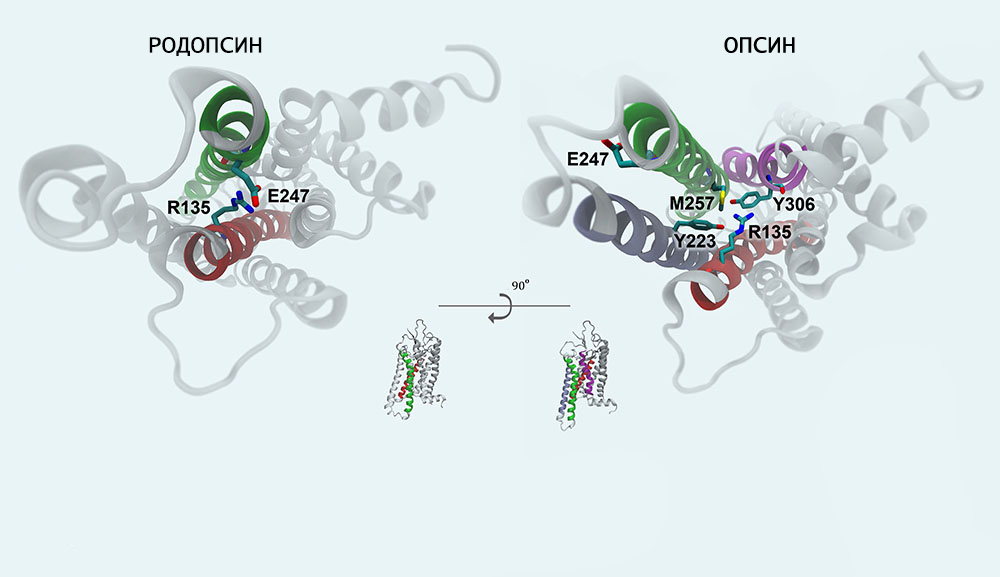
Родопсин (зрительный пурпур) — основной зрительный пигмент. Содержится в палочках сетчатки глаза морских беспозвоночных, рыб, почти всех наземных позвоночных и человека и по данным недавнего исследования в клетках кожи меланоцитах[1]. Относится к сложным белкам хромопротеинам. Модификации белка, свойственные различным биологическим видам, могут существенно различаться по структуре и молекулярной массе. Светочувствительный рецептор клеток-палочек, представитель семейства А (или семейства родопсина) G-белоксопряженных рецепторов (GPCR-рецепторов).
Функции родопсина[править | править код]
Под действием света светочувствительный зрительный пигмент изменяется, и один из промежуточных продуктов его превращения отвечает за возникновение зрительного возбуждения. Зрительные пигменты, содержащиеся в наружном сегменте фото-рецепторной клетки, представляют собой сложные окрашенные белки (хромопротеиды). Та их часть, которая поглощает видимый свет, называется хромофором. Это химическое соединение — альдегид витамина А, или ретиналь. Белок зрительных пигментов, с которыми связан ретиналь, называется опсином.
При поглощении кванта света (фотона) хромофорная группа белка (11-цис-ретиналь) изомеризуется в транс-форму. Возбуждение зрительного нерва происходит при фотолитическом разложении родопсина за счёт изменения ионного транспорта в фоторецепторе. Впоследствии родопсин восстанавливается (регенерирует) в результате синтеза 11-цис-ретиналя и опсина или в процессе синтеза новых дисков наружного слоя сетчатки.
Родопсин относится к супер семейству трансмембранных рецепторов GPCR (рецепторов, связанных с G-белками). При поглощении света конформация белковой части родопсина меняется, и он активирует G-белок трансдуцин, который активирует фермент цГМФ-фосфодиэстеразу. В результате активации этого фермента в клетке падает концентрация цГМФ и закрываются цГМФ-зависимые натриевые каналы. Так как ионы натрия постоянно выкачиваются из клетки АТФ-азой, концентрация ионов натрия внутри клетки падает, что вызывает её гиперполяризацию. В результате фоторецептор выделяет меньше тормозного медиатора ГАМК, и в биполярной нервной клетке, которая «растормаживается», возникают нервные импульсы.
Спектр поглощения родопсина[править | править код]
Специфический спектр поглощения зрительного пигмента определяется как свойствами хромофора и опсина, так и характером химической связи между ними (подробнее об этом см. обзор:[2]). Этот спектр имеет два максимума — один в ультрафиолетовой области (278 нм), обусловленный опсином, и другой — в видимой области (около 500 нм), — поглощение хромофора (см. рисунок). Превращение при действии света зрительного пигмента до конечного стабильного продукта состоит из ряда очень быстрых промежуточных стадий. Исследуя спектры поглощения промежуточных продуктов в экстрактах родопсина при низких температурах, при которых эти продукты стабильны, удалось подробно описать весь процесс обесцвечивания зрительного пигмента [3].
В живом глазу, наряду с разложением зрительного пигмента, постоянно идёт и процесс его регенерации (ресинтеза). При темновой адаптации этот процесс заканчивается только тогда, когда весь свободный опсин соединился с ретиналем.[4]
Дневное и ночное зрение[править | править код]
Из спектров поглощения родопсина видно, что восстановленный родопсин (при слабом «сумеречном» освещении) отвечает за ночное зрение, а при дневном «цветовом зрении» (ярком освещении) он разлагается, и максимум его чувствительности смещается в синюю область. При достаточном освещении палочка работает совместно с колбочкой, являясь приёмником синей области спектра[5]. Полное восстановление родопсина у человека занимает около 30 минут.
Родопсин в клетках кожи[править | править код]
По данным исследования 2011 года, проведенного в Брауновском университете, клетки кожи меланоциты также содержат родопсин. Родопсин реагирует на ультрафиолетовое излучение и запускает выработку меланина[1]
Примечания[править | править код]
- ↑ 1 2 Skin ‘sees’ UV light, starts producing pigment
- ↑ Островский М. А., Федорович С. Е., Голубев И. Н., 1967, Биофизика, 12 : 877.
- ↑ Hubbard R., Bownds D., Yoshizawa T., 1965. Cold Spring Harbor Symp. Biol., 30 : 301.
- ↑ АН СССР, объединённый научный совет «физиология человека и животных», Физиология сенсорных систем. Ч. 1. Физиология зрения. 1971 г., Издательство «Наука», Ленинградское отделение. Стр. 94 — 101
- ↑ С. Д. Ременко, «Цвет и зрение», «Картеа Молдовеняскэ», Кишинёв, 1982 г.
Этимология[править | править код]
Название «родопсин» происходит от др.-греч. ρόδον — роза и др.-греч. όπσις — зрение.
См. также[править | править код]
- Бактериородопсин
- Сенсорный родопсин II
- Родопсинкиназа
Ссылки[править | править код]
Источник
Информация в этой статье или некоторых её разделах устарела. Вы можете помочь проекту, обновив её и убрав после этого данный шаблон. |
Нормализованные кривые чувствительности йодопсинов и родопсином (штриховая линия)
Йодопсин (iodopsinum; от др.-греч. ἰώδης — «подобный цвету фиалки» + др.-греч. ωπς — глаз) — общее название нескольких зрительных пигментов человека и некоторых млекопитающих животных. Эти пигменты состоят из белковой молекулы, связанной с хромофором ретиналем. Содержатся в колбочках сетчатки глаза и обеспечивают цветовое зрение, в отличие от другого зрительного пигмента — родопсина, ответственного за сумеречное зрение.
Типы йодопсинов[править | править код]
| Тип колбочек | Название | Диапазон | Максимум чувствительности[1][2] |
|---|---|---|---|
| S (OPN1SW) — «тритан», «цианолаб» | β | 400–500 нм | 420–440 нм |
| M (OPN1MW) — «дейтан», «хлоролаб» | γ | 450–630 нм | 534–545 нм |
| L (OPN1LW) — «протан», «эритролаб» | ρ | 500–700 нм | 564–580 нм |
История исследований[править | править код]
Первые попытки найти три пигмента и, как предполагалось три типа колбочек (исходя из предположений трёхкомпонентной теории зрения, что в каждой колбочке содержится только один пигмент) проводились Раштоном[3], который довёл до совершенства методику денситометрии для прижизненного измерения коэффициентов поглощения света с различной длиной волны в слое фоторецепторов сетчатки. Было показано, что у дихроматов отсутствует один из пигментов, имеющихся у трихроматов, и соответствующих красно- и зелёночувствительному приёмникам трихромата: «эритролаб» (максимум около 585 нм.) у протанопа и «хлоролаб» (максимум около 540 нм.) — у дейтеранопа.
Обнаружить присутствие третьего (теоретически предсказанного синечувствительного пигмента) «цианолаба», который (по трёхкомпонентной теории цветового зрения) содержится в третьем «приёмнике», долго не удавалось ни у дихроматов, ни у трихроматов. Это попытались объяснить жёлтой пигментацией в районе центральной ямки, которая по мнению исследователей «затрудняет» измерения в синем конце спектра.
Следующим шагом в этом направлении явилось исследование фотопигментов, содержащихся в отдельных колбочках человека[4] и макаки[5]. Размеры фовеальных колбочек слишком малы, чтобы они могли служить объектом исследования, и все полученные данные касаются только парафовеальных колбочек. Каждая колбочка, по крайней мере внефовеальная, содержит, видимо, лишь один из пигментов или преимущественно один из них. Вопрос о локализации пигментов в фовеальных колбочках в тот период решён не был, и предполагалось, что фовеальные колбочки содержат смесь нескольких пигментов.[5].
Исследование оптических характеристик йодопсина[править | править код]
Далее последовала работа Уолда[6]. Применение интенсивного адаптирующего жёлтого, пурпурного и синего фона, позволило Уолду получить три разные пороговые кривые. Делая поправку на поглощение в передних средах глаза (хрусталик и жёлтый макулярный пигмент), Уолд называет в качестве максимумов трёх «приёмников» (хотя реально он обнаружил не приёмники, а только максимумы поглощения тканями сетчатки) 430, 540 и 575 нм.[7]
Ссылки[править | править код]
- ↑ Wyszecki, Günther; Stiles, W.S. Color Science: Concepts and Methods, Quantitative Data and Formulae (англ.). — 2nd. — New York: Wiley Series in Pure and Applied Optics, 1982. — ISBN 0-471-02106-7.
- ↑ R. W. G. Hunt. The Reproduction of Colour (неопр.). — 6th. — Chichester UK: Wiley–IS&T Series in Imaging Science and Technology, 2004. — С. 11—12. — ISBN 0-470-02425-9.
- ↑ Rushton W. A. H. 1958. In: Visual problems of colour. N. P. L. Sump. No 8, 1, Teddington : 73.
- ↑ Wald G., Brown P. K., 1964. Science, 144 : 45., Wald G., Brown P. K., 1965. Cold Spring Harbor Symp., 30 : 345
- ↑ 1 2 Marks W. B., W. H. Dobelle, E. F. McNichol. 1964. Science, 143 : 1181.
- ↑ Wald G. 1964. Science, 144 : 1007.
- ↑ АН СССР, объединённый научный совет «физиология человека и животных», Физиология сенсорных систем. Ч. 1. Физиология зрения. 1971 г., Издательство «Наука», Ленинградское отделение. Гл. 11, Цветовое зрение, Стр. 246—258
Источник
Родопсин — это распространенный зрительный пигмент, входящий в состав палочковидных зрительных рецепторов сетчатки глаза позвоночных животных. Это вещество имеет очень высокую фоточувствительность и является ключевым компонентом фоторецепции. Иное название родопсина — зрительный пурпур.
В настоящий момент к родопсинам относят пигменты не только палочек, но и рабдомерных зрительных рецепторов членистоногих.
Общая характеристика пигмента
По химической природе родопсин — это мембранный белок животного происхождения, содержащий в своей структуре хромофорную группу. Именно она обуславливает способность пигмента улавливать кванты света. Белок родопсин имеет молекулярную массу примерно 40 кДА и содержит 348 аминокислотных звеньев.
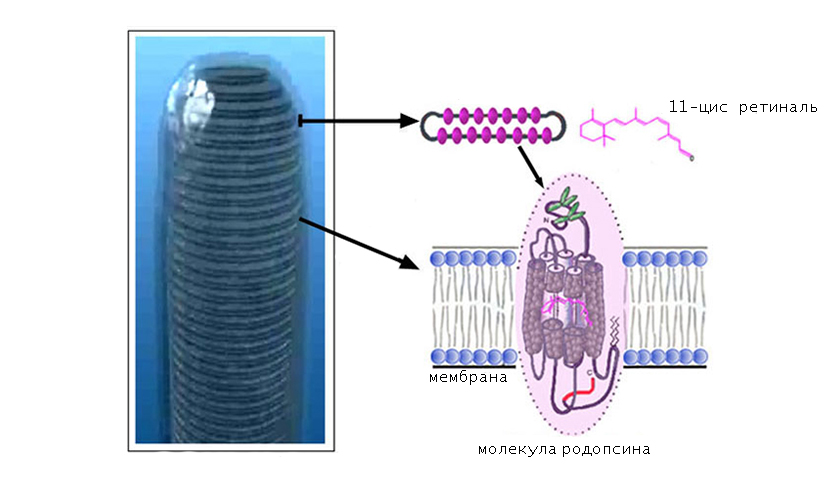
Спектр светопоглощения родопсина состоит из трех полос:
- α (500 нм);
- β (350 нм);
- γ (280 нм).
Лучи γ поглощаются ароматическими аминокислотами в составе полипептидной цепи, а β и α — хромофорной группой.
Родопсин — это вещество, способное распадаться под действием света, что запускает электротонический путь передачи сигнала по нервным волокнам. Данное свойство характерно и для других пигментов фоторецепторов.
Структура родопсина
По химической структуре родопсин — это хромогликопротеид, в состав которого входят 3 компонента:
- хромофорная группа;
- 2 олигосахаридные цепочки;
- водонерастворимый белок опсин.
В качестве хромофорной группы выступает альдегид витамина А (ретиналь), который находится в 11-цисформе. Это означает, что длинная часть цепочки ретиналя изогнута и скручена с образованием нестабильной конфигурации.
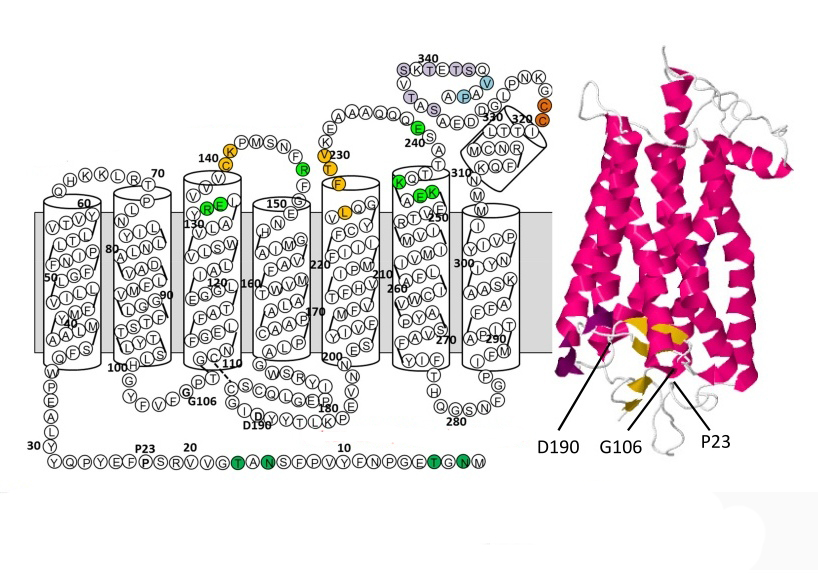
В пространственной организации молекулы родопсина выделяют 3 домена:
- внутримембранный;
- цитоплазматический;
- внутридисковый.
Хромофорная группа расположен во внутримембранном домене. Ее связь с опсином осуществляется через Шиффово основание.

Схема фотопревращения
Механизм фотопревращения пигмента родопсина под действием света основан на реакции цис-транс-изомеризации ретиналя — т. е. на конформационном переходе 11-цис-формы хромофорной группы в выпрямленную транс-форму. Этот процесс осуществляется с огромной скоростью (меньше 0,2 пикосекунды) и активирует ряд дальнейших превращений родопсина, которые происходят уже без участия света (темновая фаза).
Образующийся под действием светового кванта продукт называют фотородопсином. Его особенность в том, что транс-ретиналь еще связан с полипептидной цепью опсина.
От завершения первой реакции до конца темновой фазы родопсин последовательно претерпевает следующий ряд превращений:
- фотородопсин;
- батородопсин;
- люмиродопсин;
- метародопсин Ia;
- метародопсин Ib;
- метародопсин II;
- опсин и полностью-транс ретиналь.
Эти превращения сопровождаются стабилизацией, полученной от светового кванта энергии, и конформационной перестройкой белковой части родопсина. В результате хромофорная группа окончательно отделяется от опсина и тут же удаляется из мембраны (транс-форма обладает токсичным действием). После этого запускается процесс регенерации пигмента в исходное состояние.
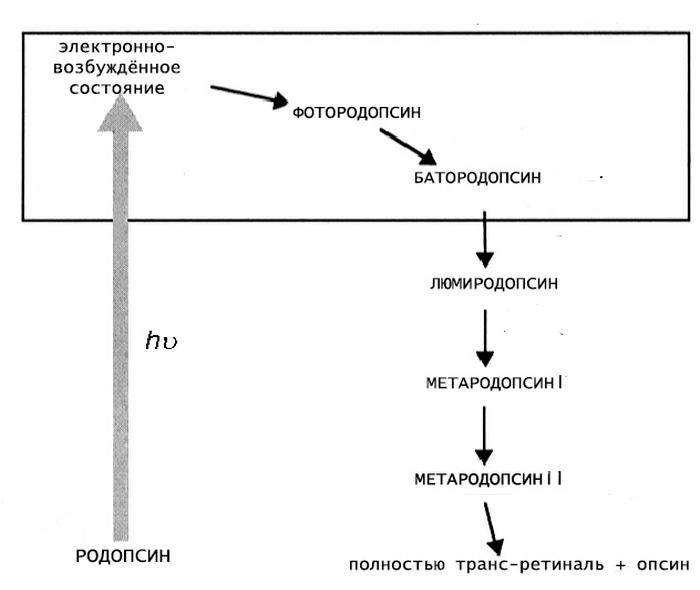
Регенерация родопсина происходит благодаря тому, что за пределами мембраны транс-ретиналь снова приобретает цис-форму, а затем возвращается обратно, где снова образует с опсином ковалентную связь. У позвоночных восстановление имеет характер ферментативного ресинтеза и происходит с затратой энергии, а у беспозвоночных осуществляется за счет фотоизомеризации.
Механизм передачи сигнала от пигмента в нервную систему
Действующим компонентом запуска фототрансдукции является метародопсин II. В таком состоянии пигмент способен взаимодействовать с белком трансдуцином, тем самым активируя его. В результате связанный с трандуцином ГДФ заменяется на ГТФ. На данной стадии происходит одновременная активизация огромного числа молекул трансдуцина (500—1000). Этот процесс называют первым этапом усиления светового сигнала.
Затем молекулы активированного трансдуцина вступают во взаимодействие с фотодиэстэразой (ФДЭ). Этот фермент в активном состоянии способен очень быстро разрушать соединение цГМФ, необходимое для поддержки в открытом состоянии ионных каналов в мембране рецептора. После вызванной трансдуцином активизации молекул ФДЭ, концентрация цГМФ падает до такого уровня, что каналы закрываются, и в клетку перестают поступать ионы натрия.
Уменьшение концентрации Na+ в цитоплазме наружной части рецептора приводит цитоплазматическую мембрану в состояние гиперполяризации. В результате возникает трансмембранный потенциал, который распространяется до пресинаптического окончания, уменьшая выброс медиатора. Именно это и является смысловым итогом процесса всех преобразований в зрительном рецепторе.
Источник
Зрительные пигменты (лат. pigmentum краска) — светочувствительные пигменты фоторецепторов сетчатки глаза. Воспринимая энергию светового импульса, Зрительные пигменты претерпевают сложный цикл фотохимических превращений, в результате которых отдельный зрительный рецептор сетчатки глаза, содержащий Зрительные пигменты (колбочка или палочка), переходит в возбужденное состояние и по зрительному нерву передает полученную информацию в ц. н. с. Являясь основной структурно-функциональной частью фоторецепторной мембраны зрительных клеток сетчатки глаза, Зрительные пигменты таким образом играют ключевую роль в механизмах зрения (см.).
Номенклатура и строение зрительных пигментов
Все изученные Зрительные пигменты позвоночных и беспозвоночных животных представляют собой комплексы водонерастворимого мембранного белка опсина и связанного с ним хромофора (ретиналя). Ретиналь, или альдегид витамина А, может существовать в двух формах — ретиналь-1 и ретиналь-2.
По природе хромофора 3. п. разделяют на два класса — родопсины (см.), содержащие ретиналь1, и порфиропсины, содержащие ретиналь2. Родопсины содержатся в сетчатой оболочке глаза всех сухопутных и морских животных, порфиропсины — в сетчатке глаз пресноводных животных. У некоторых рыб и амфибий найдены 3. п., содержащие одновременно ретиналь! и ретиналь,. Есть попытки классифицировать 3. п. на основе различий в опсинах, специфичных для палочек или колбочек сетчатки глаза. Напр., родопсин — это комплекс ретиналя1 с палочковым опсином, йодопсин — ретиналя1 с колбочковым опсином, порфиропсин — ретиналя2 с палочковым опсином, комплекс ретиналь — колбочковый опсин образует цианопсин. Однако классифицировать 3. п. на основе опсинов крайне трудно, т. к. различных опсинов, по крайней мере, пять.
Из всех известных 3. п. наиболее полно исследованы родопсины, выделенные из глаз быка, лягушки и кальмара. Их мол. вес (масса) порядка 30—40 тыс., каждая молекула содержит ок. 400 аминокислот и один хромофор. Кроме того, в состав молекулы 3. п. входит олигосахаридная цепь: 3 радикала глюкозамина, 2 маннозы, 1 галактозы. Липиды (гл. обр. фосфолипиды) образуют с молекулой 3. п. прочный комплекс. Сохраняя свои основные спектральные свойства (см. Спектральный анализ), 3. п. без липидов теряют ряд функционально важных, напр, способность к восстановлению.
Чистый ретиналь имеет желтый цвет, максимум его спектра поглощения лежит в области 370 нм. Опсин бесцветен, максимум поглощения — в ультрафиолетовой области (ок. 280 нм). Цвет молекулы родопсина красновато-розовый, максимум спектра поглощения ок. 500 нм. Причина такого сильного спектрального сдвига при образовании комплекса (с 370 до 500 нм — так наз. батохромного сдвига) не получила до сих пор однозначного объяснения.
Максимумы спектров поглощения родопсинов и порфиропсинов захватывают достаточно широкую область видимого спектра — от 433 до 562 нм у родопсинов и от 510 до 543 нм у порфиропсинов. Если же к порфиропсинам относить и 3. п. колбочек головастика лягушки, карпа и пресноводной черепахи, т. е. цианопсин с максимумом спектра поглощения при 620 нм, то эта область оказывается еще шире. Развитие методов микроспектрофотометрии позволило определить спектры поглощения многих типов одиночных фоторецепторных клеток животных и человека. По полученным данным, 3. п. сетчатки человека имеют следующие максимумы спектров поглощения: палочки 498, сине-, зелено- и красночувствительные колбочки — 440, 535 и 575 нм соответственно.
Изучение Зрительных пигментов начато нем. исследователем Мюллером (H. Muller), который в 1851 г. описал, как извлеченная из глаза лягушки розовато-пурпурная сетчатка становится на свету сначала желтоватой, а потом белесой. В 1877 г. Болль (F. Boll) также описал этот феномен, сделав вывод, что в зрительных клетках сетчатки находится какое-то красное светочувствительное вещество и что обесцвечивание этого вещества связано с механизмом зрения. Большая заслуга в изучении 3. п. принадлежит Кюне (W. Kuhne, 1877), к-рому удалось выделить 3. п. и подробно исследовать их. Он назвал извлеченный им 3. п. зрительным пурпуром, установил его белковую природу, исследовал некоторые его спектральные свойства и фотопревращения, обнаружил способность 3. п. к восстановлению в темноте. Большой вклад в изучение 3. п. внес амер. биохимик и физиолог Дж. Уолд.
Фотопревращения зрительных пигментов
При действии на 3. п. света в них происходит цикл фотохимических превращений, в основе к-рого лежит первичная фотохимическая реакция цис-транс-изомеризации ретиналя (см. Изомерия). При этом происходит нарушение связи хромофора с белком. Последовательность превращений 3. п. может быть представлена следующим образом: родопсин (хромофор находится в цис-форме) —> прелюмиродопсин —> люмиродопсин —> метародопсин I —> метародопсин II —> белок опсин —> хромофор в транс-форме. Под влиянием фермента — ретинолдегидрогеназы — последний переходит в витамин А, который поступает из наружных члеников палочек и колбочек в клетки пигментного слоя сетчатки. При затемнении глаза происходит регенерация 3. п., для осуществления к-рой необходимо наличие цис-изомера витамина А, служащего исходным продуктом для образования хромофора (альдегида витамина А). При недостатке или отсутствии в организме витамина А может нарушиться образование родопсина и развиться как следствие расстройство сумеречного зрения, так наз. куриная слепота (см. Гемералопия). В процессе фотопревращений родопсина на стадии перехода люмиродопсина в метародопсин I в рецепторной клетке возникает в ответ на яркую вспышку так наз. ранний (коротколатентный) рецепторный потенциал. Вместе с тем он не является зрительным сигналом, хотя и может служить одним из тестов для исследования механизма превращений 3. п. в фоторецепторной мембране. Функциональное значение имеет так наз. поздний рецепторный потенциал, латентный период к-рого (5—10 мсек) соизмерим со временем образования метародопсина II. Предполагают, что реакция перехода метародопси-на I в метародопсин II обеспечивает возникновение зрительного сигнала.
Поскольку на свету Зрительные пигменты непрерывно обесцвечиваются, то должны существовать механизмы их постоянного восстановления. Одни из них чрезвычайно быстрые (фоторегенерация), другие достаточно быстрые, (биохимическая регенерация, Темновая), третьи медленные (синтез 3. п. в ходе постоянного обновления фоторецепторной мембраны в зрительной клетке). Фоторегенерация имеет физиол, значение у беспозвоночных животных (напр., у головоногих моллюсков — кальмаров, осьминогов). В механизме биохим. регенерации 3. п. у позвоночных важную роль, по-видимому, играет фермент изомераза (см.), обеспечивающий изомеризацию транс-ретиналя (или транс-витамина А) снова в цис-изомерную форму. Однако окончательных доказательств существования такого фермента пока не имеется. Сама же реакция образования молекулы Зрительного пигмента при наличии в системе 11-цис-изомера ретиналя и опсина происходит легко, без затраты энергии. Обнаружена способность обесцвеченного родопсина к реакции фосфорилирования (см.); предполагается, что эта реакция является одним из звеньев механизма световой адаптации зрительной клетки.
См. также Фотохимические реакции.
Библиография: Аккерман Ю. Биофизика, пер. с англ., М., 1964; Вилли К. и Деть e В. Биология, пер. с англ., М., 1974, библиогр.; Конев С. В. и Волотовский И. Д. Введение в молекулярную фотобиологию, с. 61, Минск, 1971; Островский М. А. и Федорович И. Б. Фотоиндуцированные изменения фоторецепторной мембраны, в кн.: Структура и функции биол, мембран, под ред. А. С. Трошина и др., с. 224, М., 1975, библиогр.; Физиология сенсорных систем, под ред. Г. В. Гершуни, ч. 1, с. 88, Л., 1971; Biochemistry and physiology of visual pigments, ed. by H. Lan-ger, В. a. o., 1973; Handbook of sensory physiology, ed. by H. A. R. Jung a. o., v. 7, pt 1—2, B., 1972.
М. А. Островский.
Источник
