Родопсин в каком витамине

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 27 марта 2019;
проверки требуют 3 правки.
Родопсин (зрительный пурпур) — основной зрительный пигмент. Содержится в палочках сетчатки глаза морских беспозвоночных, рыб, почти всех наземных позвоночных и человека и по данным недавнего исследования в клетках кожи меланоцитах[1]. Относится к сложным белкам хромопротеинам. Модификации белка, свойственные различным биологическим видам, могут существенно различаться по структуре и молекулярной массе. Светочувствительный рецептор клеток-палочек, представитель семейства А (или семейства родопсина) G-белоксопряженных рецепторов (GPCR-рецепторов).
Функции родопсина[править | править код]
Под действием света светочувствительный зрительный пигмент изменяется, и один из промежуточных продуктов его превращения отвечает за возникновение зрительного возбуждения. Зрительные пигменты, содержащиеся в наружном сегменте фоторецепторной клетки, представляют собой сложные окрашенные белки (хромопротеиды). Та их часть, которая поглощает видимый свет, называется хромофором. Это химическое соединение — альдегид витамина А, или ретиналь. Белок зрительных пигментов, с которыми связан ретиналь, называется опсином.
При поглощении кванта света (фотона) хромофорная группа белка (11-цис-ретиналь) изомеризуется в транс-форму. Возбуждение зрительного нерва происходит при фотолитическом разложении родопсина за счёт изменения ионного транспорта в фоторецепторе. Впоследствии родопсин восстанавливается (регенерирует) в результате синтеза 11-цис-ретиналя и опсина или в процессе синтеза новых дисков наружного слоя сетчатки.
Родопсин относится к супер семейству трансмембранных рецепторов GPCR (рецепторов, связанных с G-белками). При поглощении света конформация белковой части родопсина меняется, и он активирует G-белок трансдуцин, который активирует фермент цГМФ-фосфодиэстеразу. В результате активации этого фермента в клетке падает концентрация цГМФ и закрываются цГМФ-зависимые натриевые каналы. Так как ионы натрия постоянно выкачиваются из клетки АТФ-азой, концентрация ионов натрия внутри клетки падает, что вызывает её гиперполяризацию. В результате фоторецептор выделяет меньше тормозного медиатора ГАМК, и в биполярной нервной клетке, которая «растормаживается», возникают нервные импульсы.
Спектр поглощения родопсина[править | править код]
Специфический спектр поглощения зрительного пигмента определяется как свойствами хромофора и опсина, так и характером химической связи между ними (подробнее об этом см. обзор:[2]). Этот спектр имеет два максимума — один в ультрафиолетовой области (278 нм), обусловленный опсином, и другой — в видимой области (около 500 нм), — поглощение хромофора (см. рисунок). Превращение при действии света зрительного пигмента до конечного стабильного продукта состоит из ряда очень быстрых промежуточных стадий. Исследуя спектры поглощения промежуточных продуктов в экстрактах родопсина при низких температурах, при которых эти продукты стабильны, удалось подробно описать весь процесс обесцвечивания зрительного пигмента [3].
В живом глазу, наряду с разложением зрительного пигмента, постоянно идёт и процесс его регенерации (ресинтеза). При темновой адаптации этот процесс заканчивается только тогда, когда весь свободный опсин соединился с ретиналем.[4]
Дневное и ночное зрение[править | править код]
Из спектров поглощения родопсина видно, что восстановленный родопсин (при слабом «сумеречном» освещении) отвечает за ночное зрение, а при дневном «цветовом зрении» (ярком освещении) он разлагается, и максимум его чувствительности смещается в синюю область. При достаточном освещении палочка работает совместно с колбочкой, являясь приёмником синей области спектра[5]. Полное восстановление родопсина у человека занимает около 30 минут.
Родопсин в клетках кожи[править | править код]
По данным исследования 2011 года, проведенного в Брауновском университете, клетки кожи меланоциты также содержат родопсин. Родопсин реагирует на ультрафиолетовое излучение и запускает выработку меланина[1]
Примечания[править | править код]
- ↑ 1 2 Skin ‘sees’ UV light, starts producing pigment
- ↑ Островский М. А., Федорович С. Е., Голубев И. Н., 1967, Биофизика, 12 : 877.
- ↑ Hubbard R., Bownds D., Yoshizawa T., 1965. Cold Spring Harbor Symp. Biol., 30 : 301.
- ↑ АН СССР, объединённый научный совет «физиология человека и животных», Физиология сенсорных систем. Ч. 1. Физиология зрения. 1971 г., Издательство «Наука», Ленинградское отделение. Стр. 94 — 101
- ↑ С. Д. Ременко, «Цвет и зрение», «Картеа Молдовеняскэ», Кишинёв, 1982 г.
Этимология[править | править код]
Название «родопсин» происходит от др.-греч. ρόδον — роза и др.-греч. όπσις — зрение.
См. также[править | править код]
- Бактериородопсин
- Сенсорный родопсин II
- Родопсинкиназа
Ссылки[править | править код]
Источник
Фотохимия зрения. Родопсин и его распад под действием светаИ палочки, и колбочки содержат вещества, которые распадаются под действием света, в результате возбуждаются нервные волокна, выходящие из глаза. Светочувствительное вещество в палочках называют родопсином; состав светочувствительных веществ в колбочках, называемых пигментами колбочек, или цветными пигментами, лишь немного отличается от родопсина. Наружный сегмент палочки, погруженный в пигментный слой сетчатки, примерно на 40% состоит из светочувствительного пигмента родопсина, или зрительного пурпура. Это вещество представляет собой соединение белка скотопсина и каротиноидного пигмента ретиналя (или ретинена). Важно, что ретиналь представлен в особой форме — 11 -цис-ретиналь, поскольку только эта цис-форма может связываться со скотопсином для синтеза родопсина. Причиной этого является фотоактивация электронов в ретинальной части родопсина, что ведет к немедленному превращению цис-формы ретиналя в полностью-транс-форму, которая имеет ту же химическую структуру, что и цис-форма, но другую физическую структуру — прямую, а не изогнутую молекулу. Поскольку трехмерная ориентация реактивных участков полностью-транс-ретиналя больше не сходится с ориентацией реактивных участков белка скотопсина, эта форма ретиналя начинает отделяться от скотопсина.
Батородопсин — весьма нестабильное вещество, которое распадается в течение наносекунд до люмиродопсина. Последний, в свою очередь, распадается в течение микросекунд до метародопсина I, затем в течение примерно миллисекунды превращается в метародопсин II и, наконец, гораздо медленнее (в течение нескольких секунд) расщепляется на отдельные продукты — скотопсин и полностью-транс-ретиналь. Именно метародопсин II, называемый также активированным родопсином, вызывает электрические изменения в палочках, которые затем передают зрительный образ в центральную нервную систему в форме потенциалов действия зрительного нерва, что будет изложено далее. Восстановление родопсина. Первой стадией восстановления родопсина является обратное превращение полностью- транс-ретиналя в 11-цис-ретиналь. Этот процесс нуждается в метаболической энергии и катализируется ферментом ретиналь-изомеразой. Сразу после образования 11-цис-ретиналя он автоматически соединяется со скотопсином, вновь формируя родопсин, который остается стабильным, пока снова не начнется его распад при поглощении световой энергии. Роль витамина А в формировании родопсина. На рисунке показан второй химический путь, с помощью которого полностью- транс-ретиналь может превращаться в 11-цис-ретиналь. Это происходит путем конверсии полностью-транс-ретиналя сначала в полностью-транс-ретинол — одну из форм витамина А. Затем под влиянием фермента изомеразы полностью- транс-ретинол превращается в 11-цис-ретинол. Наконец, 11-цис-ретинол конвертируется в 11-цис-ретиналь, который комбинируется со скотопсином, формируя новый родопсин. Витамин А присутствует и в цитоплазме палочек, и в пигментном слое сетчатки. Следовательно, в норме при необходимости он всегда доступен для формирования нового ретиналя. С другой стороны, при избытке ретиналя в сетчатке он легко превращается снова в витамин А, уменьшая таким образом количество светочувствительного пигмента. Позднее мы увидим, что взаимопревращения ретиналя и витамина А особенно важны при долговременной адаптации сетчатки к различной интенсивности света. — Также рекомендуем «Ночная слепота. Возбуждение палочек при активации родопсина светом» Оглавление темы «Оптическая составляющая зрительного аппарата»: |
Источник
Родопсин — это распространенный зрительный пигмент, входящий в состав палочковидных зрительных рецепторов сетчатки глаза позвоночных животных. Это вещество имеет очень высокую фоточувствительность и является ключевым компонентом фоторецепции. Иное название родопсина — зрительный пурпур.
В настоящий момент к родопсинам относят пигменты не только палочек, но и рабдомерных зрительных рецепторов членистоногих.
Общая характеристика пигмента
По химической природе родопсин — это мембранный белок животного происхождения, содержащий в своей структуре хромофорную группу. Именно она обуславливает способность пигмента улавливать кванты света. Белок родопсин имеет молекулярную массу примерно 40 кДА и содержит 348 аминокислотных звеньев.
Спектр светопоглощения родопсина состоит из трех полос:
- α (500 нм);
- β (350 нм);
- γ (280 нм).
Лучи γ поглощаются ароматическими аминокислотами в составе полипептидной цепи, а β и α — хромофорной группой.
Родопсин — это вещество, способное распадаться под действием света, что запускает электротонический путь передачи сигнала по нервным волокнам. Данное свойство характерно и для других пигментов фоторецепторов.
Структура родопсина
По химической структуре родопсин — это хромогликопротеид, в состав которого входят 3 компонента:
- хромофорная группа;
- 2 олигосахаридные цепочки;
- водонерастворимый белок опсин.
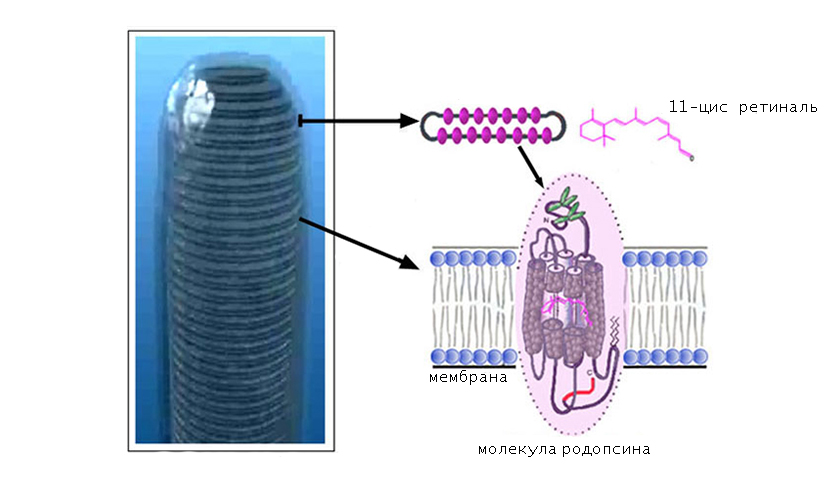
В качестве хромофорной группы выступает альдегид витамина А (ретиналь), который находится в 11-цисформе. Это означает, что длинная часть цепочки ретиналя изогнута и скручена с образованием нестабильной конфигурации.
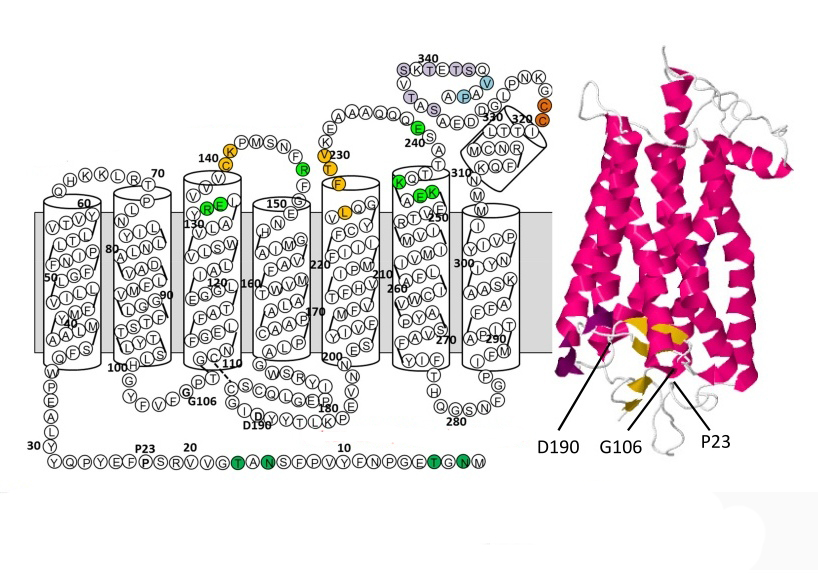
В пространственной организации молекулы родопсина выделяют 3 домена:
- внутримембранный;
- цитоплазматический;
- внутридисковый.
Хромофорная группа расположен во внутримембранном домене. Ее связь с опсином осуществляется через Шиффово основание.
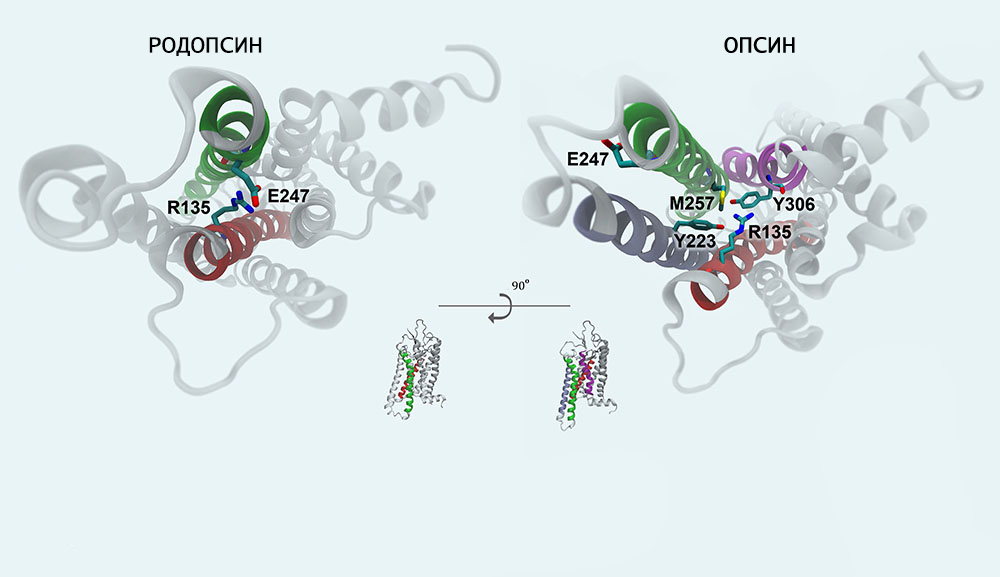
Схема фотопревращения
Механизм фотопревращения пигмента родопсина под действием света основан на реакции цис-транс-изомеризации ретиналя — т. е. на конформационном переходе 11-цис-формы хромофорной группы в выпрямленную транс-форму. Этот процесс осуществляется с огромной скоростью (меньше 0,2 пикосекунды) и активирует ряд дальнейших превращений родопсина, которые происходят уже без участия света (темновая фаза).
Образующийся под действием светового кванта продукт называют фотородопсином. Его особенность в том, что транс-ретиналь еще связан с полипептидной цепью опсина.
От завершения первой реакции до конца темновой фазы родопсин последовательно претерпевает следующий ряд превращений:
- фотородопсин;
- батородопсин;
- люмиродопсин;
- метародопсин Ia;
- метародопсин Ib;
- метародопсин II;
- опсин и полностью-транс ретиналь.
Эти превращения сопровождаются стабилизацией, полученной от светового кванта энергии, и конформационной перестройкой белковой части родопсина. В результате хромофорная группа окончательно отделяется от опсина и тут же удаляется из мембраны (транс-форма обладает токсичным действием). После этого запускается процесс регенерации пигмента в исходное состояние.
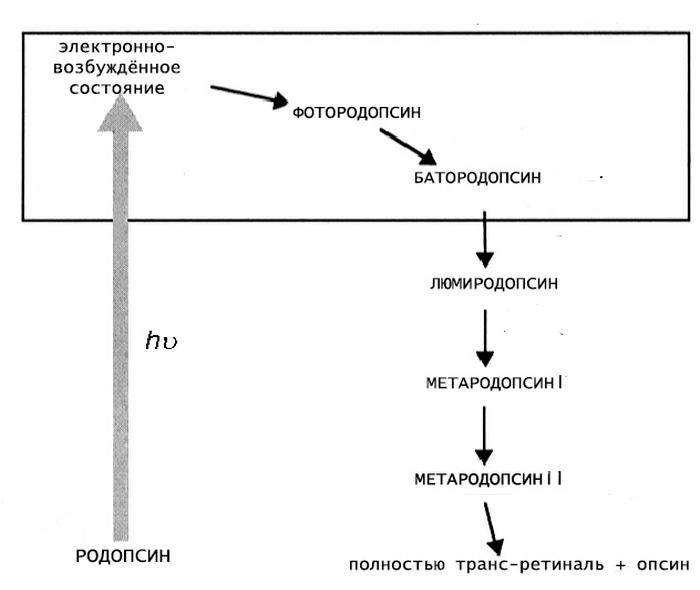
Регенерация родопсина происходит благодаря тому, что за пределами мембраны транс-ретиналь снова приобретает цис-форму, а затем возвращается обратно, где снова образует с опсином ковалентную связь. У позвоночных восстановление имеет характер ферментативного ресинтеза и происходит с затратой энергии, а у беспозвоночных осуществляется за счет фотоизомеризации.
Механизм передачи сигнала от пигмента в нервную систему
Действующим компонентом запуска фототрансдукции является метародопсин II. В таком состоянии пигмент способен взаимодействовать с белком трансдуцином, тем самым активируя его. В результате связанный с трандуцином ГДФ заменяется на ГТФ. На данной стадии происходит одновременная активизация огромного числа молекул трансдуцина (500—1000). Этот процесс называют первым этапом усиления светового сигнала.
Затем молекулы активированного трансдуцина вступают во взаимодействие с фотодиэстэразой (ФДЭ). Этот фермент в активном состоянии способен очень быстро разрушать соединение цГМФ, необходимое для поддержки в открытом состоянии ионных каналов в мембране рецептора. После вызванной трансдуцином активизации молекул ФДЭ, концентрация цГМФ падает до такого уровня, что каналы закрываются, и в клетку перестают поступать ионы натрия.
Уменьшение концентрации Na+ в цитоплазме наружной части рецептора приводит цитоплазматическую мембрану в состояние гиперполяризации. В результате возникает трансмембранный потенциал, который распространяется до пресинаптического окончания, уменьшая выброс медиатора. Именно это и является смысловым итогом процесса всех преобразований в зрительном рецепторе.
Источник
→ Палочки (сетчатка)
→ Опсины

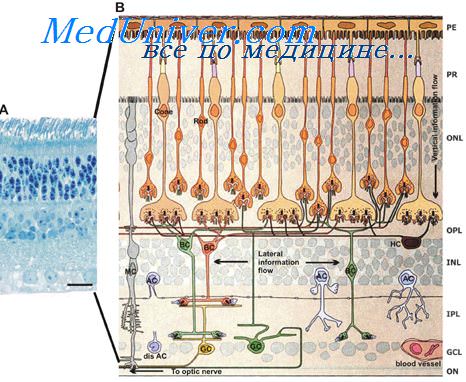
![]()
Трехмерная структура бычьего родопсина. Семь трансмембранных доменов показаны разными цветами. Хромофор показан красным цветом.
Родопси́н (от др.-греч. ρόδον — роза и др.-греч. όπσις — зрение; иногда в качестве синонима используют устаревшее название — зри́тельный пу́рпур) — группа зрительных пигментов, несколько различных по строению у разных видов животных (см. опсины). Содержится в палочках сетчатки глаза морских беспозвоночных, рыб, почти всех наземных позвоночных и человека. Относится к сложным белкам — хромопротеинам.
Модификации белка, свойственные различным биологическим видам, могут существенно различаться по структуре и молекулярной массе.
Родопсин принадлежит к обширному семейству G-белоксопряжённых рецепторов (GPCR-рецепторов), названному так за механизм трансмембранной передачи сигнала, основанный на взаимодействии с внутриклеточными примембранными G-белками. Появление его пространственной структуры, полученной с высоким экспериментальным разрешением, является очень важным событием для биологии и медицины, поскольку родопсин как «родоначальник» семейства А GPCR-рецепторов является своего рода «моделью» структуры и функций множества других рецепторов, чрезвычайно интересных с фундаментальной и практической (фармакологической) точек зрения. Свое название родопсин получил за ярко-красный цвет (по-гречески rhodon — означает «розовый», a opsis — зрение).
[править] История открытия и исследований родопсина
Пурпурная окраска клеток-палочек была обнаружена Генрихом Мюллером (Heinrich Müller) в 1851 году; он приписал её гемоглобину. Он извлек из глаза лягушки сетчатку; она оказалась розовато-пурпурной, но очень скоро обесцветилась. Это столь интересное наблюдение было забыто.
В 1876 году Франц Болл (Franz Boll, 1876) из Римского университета выделил фоточувствительный пигмент из палочки сетчатки лягушки. Он обнаружил, что сетчатка лягушки чувствительна к свету, и после освещения меняет свою окраску на жёлтую, с последующим обесцвечиванием. Болл также продемонстрировал, что после некоторого времени пребывания в темноте сетчатка животных приобретает изначальную яркую окраску.
Вилли Кюхне (Willy Kühne), физиолог из Германии, продолживший работы Франца Болла, определил, что пигмент, отвечающий за окраску сетчатки — это белок наружных сегментов палочек (НСП), и назвал его «зрительным пурпуром» (родопсином). Кюхне выделил родопсин из клеток пигментного эпителия сетчатки, сравнил спектроскопические свойства этого белка и препарата сетчатки. Он постулировал, что жёлтый и бесцветный продукты, образующиеся под действием света, химически различны, и заключил, что генерация сетчаткой электрических импульсов является следствием реакции на свет.
В 1933 году строение и химические свойства родопсина были изучены Джорджем Уолдом и его коллегами по Гарвардскому университету, которые впервые выделили из препарата сетчатки вещество, первоначально идентифицированное как витамин А, что объяснило феномен «куриной слепоты» у пациентов с авитаминозом по этому каротиноиду (к тому времени еще мало было известно о биохимической роли витаминов). Позже оказалось, что кофактором является ретиналь — соответствующий витамину А (ацетату ретинола) альдегид. Уолд и коллеги продемонстрировали, что ретиналь, добавленный в темноте к обесцвеченному родопсину, способен восстанавливать «свежий» пигмент, причём этим действием обладает только 11-цис-изомер. Они открыли, что родопсин состоит из двух компонентов — бесцветного белка, называемого опсином или жёлтым пигментом и 11-цис-ретиналя, ковалентно связанного хромофора каротиноидной природы, акцептирующего свет. В 1967 году Уолд получил Нобелевскую премию по физиологии и медицине «за исследования в области физиологии и биохимии зрения», а также за открытие биохимической роли витамина А (см. Нобелевская речь Уолда, 1967, на англ. языке).
Полная аминокислотная последовательность родопсина была определена в 1982 году в Институте биоорганической химии АН СССР Ю. А. Овчинниковым и сотр. и несколько позже подтверждена анализом структурного гена родопсина Д. Хоггнесом и Дж. Натансом в США. Было показано, что в последовательности родопсина длиной 348 аминокислотных остатков присутствует семь протяжённых участков, состоящих из неполярных аминокислотных остатков, образующих трансмембранные (ТМ) α-спирали, соединенные вне- и внутриклеточными участками-«петлями». При этом N-конец находится во внеклеточной области, а C-конец — в цитоплазматической. Такая топология рецептора была подтверждена ограниченным протеолизом белка в составе нативной мембраны, обработкой моноклональными антителами и химической модификацией проникающими и непроникающими агентами. Также было установлено место прикрепления кофактора: ретиналь связывается альдиминной связью с остатком ЛИЗ-296, находящимся в седьмой (последней) ТМ α-спирали.
Пространственная структура родопсина долго не поддавалась изучению «прямыми» методами, рентгеноструктурным анализом (РСА) и спектроскопией ядерного магнитного резонанса (ЯМР). В то время как атомная структура другого мембранного белка, со схожей семиспиральной топологией (бактериородопсин) была определена Гендерсоном и сотр. еще в 1990-м году, структура зрительного родопсина высокого разрешения оставалась неизвестной до 2000 года.
[править] Структура молекулы родопсинов
[править] Родопсины микроорганизмов
→ Бактериородопсин
[править] Родопсины млекопитающих
[править] Функции родопсина
Под действием света светочувствительный зрительный пигмент изменяется и один из промежуточных продуктов его превращения непосредственно ответствен за возникновение зрительного возбуждения. Зрительные пигменты, содержащиеся в наружном сегменте фоторецепторной клетки, представляют собой сложные окрашенные белки (хромопротеиды). Та их часть, которая поглощает видимый свет, называется хромофором. Это химическое соединение — альдегид витамина А, или ретиналь. Белок зрительных пигментов, с которыми связан ретиналь, называется опсином.
При поглощении кванта света (фотона) хромофорная группа белка (11-цис-ретиналь) изомеризуется в транс-форму. Возбуждение зрительного нерва происходит при фотолитическом разложении родопсина за счёт изменения ионного транспорта в фоторецепторе. Впоследствии родопсин восстанавливается (регенерирует) в результате синтеза 11-цис-ретиналя и опсина или в процессе синтеза новых дисков наружного слоя сетчатки.
Родопсин относится к суперсемейству трансмембранных рецепторов GPCR (рецепторов, связанных с G-белками). При поглощении света конформация белковой части родопсина меняется, и он активирует G-белок трансдуцин, который активирует фермент цГМФ-фосфодиэстеразу. В результате активации этого фермента в клетке падает концентрация цГМФ и закрываются цГМФ-зависимые натриевые каналы. Так как ионы натрия постоянно выкачиваются из клетки АТФ-азой, концентрация ионов натрия внутри клетки падает, что вызывает её гиперполяризацию. В результате фоторецептор выделяет меньше тормозного медиатора глутамата, и в биполярной нервной клетке, которая «растормаживается», возникают нервные импульсы.
[править] Спектр поглощения родопсина

![]()
Рис. 1. Спектры поглощения Родопсина. 1 — спектр поглощения восстановленного родопсина (при сумеречном зрении), 2 — спектр поглощения обесцвеченного родопсина (при дневном зрении)
Специфический спектр поглощения зрительного пигмента определяется как свойствами хромофора и опсина, так и характером химической связи между ними (подробнее об этом см. обзор:[1]). Этот спектр имеет два явных максимума — один в ультрафиолетовой области (278 нм.), обусловленный опсином, и другой — в видимой области (около 500 нм.), — поглощение хромофора рис. 1. Превращение при действии света зрительного пигмента до конечного стабильного продукта состоит из ряда очень быстрых промежуточных стадий. Исследуя спектры поглощения промежуточных продуктов в экстрактах родопсина при низких температурах, при которых эти продукты стабильны, удалось подробно описать весь процесс обесцвечивания зрительного пигмента[2].
На Рис. 1 показаны спектры поглощения родопсина лягушки Rana temporaria в дигитониновом экстракте. По оси абсцисс — длина волны (λ); по оси ординат — оптическая плотность (D).
На спектре поглощения восстановленного родопсина (измеренного при слабом освещении, график 1) видны два основных максимума поглощения в видимой (500 нм.) и ультрафиолетовой (280 нм.) области. На спектре поглощения обесцвеченного родопсина (измеренного при сильном освещении, график 2) наблюдается единственный максимум поглощения с длиной волны 380 нм.
Спектр поглощения родопсина, содержит три основные полосы: α — (500 нм), β — (350 нм), γ — (280 нм). Полосы α — (500 нм) и β — (350 нм) относятся к области поглощения хромоформной группы. Полоса γ — (280 нм) — относится к группе поглощения ароматических аминокислот белка — триптофана, тирозина и фенилаланина. Так α-полоса в спектре поглощения родопсина расположена на графике кривой палочкового сумеречного видения (зрения) с предельной величиной в зоне лучей сине-зелёной области спектра (то есть 500нм).[3]
В хрусталике глаза и тканях сетчатки существует пигмент типа меланина, анологичный тому, что содержится в коже. Он имеет желтоватый или коричневый оттенок и служит для того, чтобы предотвратить попадание определённой части световой энергии, в особенности коротковолновой энергии, на сетчатку. При этом он является светофильтром отсекающим губительную для тканей и рецепторов УФ область спектра[4].[5]. Поэтому, при достаточном для различения цветов уровне освещения, максимум чувствительности палочки (в которой содержится родопсин) находится не в ультрафиолетовой, а в синей части спектра.
В живом глазу наряду с разложением зрительного пигмента, естественно, постоянно идёт процесс его регенерации (ресинтеза). При темновой адаптации этот процесс заканчивается только тогда, когда весь свободный опсин соединился с ретиналем.[6]
[править] Дневное и ночное зрение
Из спектров поглощения родопсина видно, что восстановленный родопсин (при слабом «сумеречном» освещении) отвечает за ночное зрение, а при дневном «цветовом зрении» (ярком освещении) разлагается, его фоточувствительность уменьшается, а максимум его чувствительности смещается в синюю область. Это наглядно показывает известный Эффект Пуркинье.[7].
С родопсином связан также эффект Пуркинье, который вызван более высокой чувствительностью колбочек в сетчатке глаза к желтому свету, тогда как палочки более чувствительны к синему свету, но при этом только палочки неспособны обеспечить цветное зрение. В результате красные цвета в сумерках кажутся более тёмными, нежели зелёные, а в ночное время — практически чёрными, в то время как синие объекты «становятся» более светлыми. В условиях низкой освещённости, когда колбочкам недостаточно света для функционирования, человек «видит» палочками, но в чёрно-белом цвете.
Полное восстановление родопсина у человека (в темноте или при слабом освещении) занимает около 30 минут; в течении всего этого периода чувствительность «сумеречного зрения» человека постепенно увеличивается, достигая максимума.
[править] См. также
- Теории цветового зрения
- Палочки (сетчатка)
[править] Источники
- ↑ Островский М. А., Федорович С. Е., Голубев И. Н., 1967, Биофизика, 12 : 877.
- ↑ Hubbard R., Bownds D., Yoshizawa T., 1965. Cold Spring Harbor Symp. Biol., 30 : 301.
- ↑ https://library.biophys.msu.ru/PDF/3353.pdf
- ↑ Deane B. Judd and Gunter Wyszecki, Color in business, science and industry, New York/London/Sydney/Toronto, 1975.
- ↑ Д. Джадд, Г. Вышецки, Цвет в науке и технике, Изд. «мир», Москва 1978 г., стр 25.
- ↑ АН СССР, объединённый научный совет «физиология человека и животных», Физиология сенсорных систем. Ч. 1. Физиология зрения. 1971 г., Издательство «Наука», Ленинградское отделение. Стр. 94 — 101
- ↑ Ричард Филлипс Фейнман. Фейнмановские Лекции по Физике, том № 3, гл. 35 (Цветовое зрение), стр. 157.
[править] Литература
- Страйер Л., Биохимия. пер. с англ., т. 3, М., 1985, с. 340—348
- Абдулаев, Нажмутин Гаджимагомедович. Родопсины: структура и функции. Автореф. д.х.н., М., 1985
- N. N. Vsevolodov. Biomolecular electronics: an introduction via photosensitive proteins
- Ovchinnikov Yu. А., «FEES letters», 1982, v. 148(2), p. 179—191
- Applebury M., Hargrave P., «Visual Res.», 1986, v. 26 (12), p. 1881—1895
- Shichida Y., «Photobio-chemistry and Photobiophysics», 1986, v. 13 (3), p. 287—307
- Pugh E., Cobbs W., «Visual Res.», 1986, v. 26 (10), p. 1613—1643
- Bennett N.. Sitaramayya A., «Biochemistry», 1988, v. 27 (5), p. 1710—1715
[править] Ссылки
- The Rhodopsin Protein
- Photoisomerization of rhodopsin, animation.
- Rhodopsin and the eye, summary with pictures.
Источник