Какой витамин входит в состав тдф
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 сентября 2017;
проверки требуют 2 правки.
| Тиаминпирофосфат | |
|---|---|
| Систематическое наименование | Тиамина пирофосфат |
| Хим. формула | C12H19N4O7P2S+ |
| Состояние | белые кристаллы |
| Молярная масса | 425.314382 г/моль |
| Рег. номер CAS | 57-13-6 |
| PubChem | 1132 |
| SMILES | [n+]1(c(c(CCO[P@@](OP(O)(O)=O)(O)=O)sc1)C)Cc1c(nc(C)nc1)N.[ClH-] |
| InChI | 1S/C12H18N4O7P2S/c1-8-11(3-4-22-25(20,21)23-24(17,18)19)26-7-16(8)6-10-5-14-9(2)15-12(10)13/h5,7H,3-4,6H2,1-2H3,(H4-,13,14,15,17,18,19,20,21)/p+1 AYEKOFBPNLCAJY-UHFFFAOYSA-O |
| ChEBI | 9532 |
| ChemSpider | 1100 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Тиаминпирофосфат, также тиаминдифосфат, кокарбоксилаза — органическое гетероциклическое соединение, тиаминсодержащий кофермент ряда ферментов окислительного и неокислительного декарбоксилирования α-кетокислот (пировиноградной и а-кетоглютаровой кислот) и обмене α-кетосахаров. Применяется в медицине.
В соединении с белком и ионами магния входит в состав фермента карбоксилазы, катализирующей карбоксилирование и декарбоксилирование a-кетокислот (например, в превращении пировиноградной кислоты в ацетилкофермент А). Во всех случаях происходит разрыв С—С связи, смежной с кетогруппой субстрата.[1]
Является готовой формой кофермента, образующегося из тиамина в процессе его превращения в организме.[2]
Может катализировать некоторые реакции без участия белкового компонента.[1]
История открытия[править | править код]
Впервые ферментативное декарбоксилирование α-кетокислот было описано Нойбергом в 1911 г.[3], продемонстрировавшим, что экстракт из дрожжей расщепляет пировиноградную кислоту на ацетальдегид и углекислый газ. Вместе с тем, если дрожжи предварительно промывали щелочным фосфатным буфером, то такой экстракт не проявлял декарбоксилирующей активности, однако активность восстанавливалась при добавлении прокипяченного экстракта свежих дрожжей. Термостабильный фактор экстракта, необходимый для ферментативного декарбоксилирования пировиноградной кислоты, был назван кокарбоксилазой (ко-фермент карбоксилазы).
В 1926 г. Янсен и Донат выделили в чистом виде тиамин [4], в 1937 г. Ломан и Шустер выделили чистую «кокарбоксилазу» — диализуемый кофактор окислительного декарбоксилирования пировиноградной кислоты ферментами дрожжей[5], она была идентифицирована как производное тиамина — тиаминпирофосфат.
Механизм каталитического действия[править | править код]
Реакционным центром в тиамина является углеродный атом в положении 2 тиазольного кольца. Тиазольный фрагмент тиамина является четвертичной тиазолиевой солью, кватернизованной по атому азота. Соли тиазолия, незамещённые в положении 2, способны терять протон с образованием илидов.
Такие илиды способны реагировать с карбонильными группами кетокислот и альдегидов с образованием соответствующих 2-тиазолилкарбинолов. Эти соединения являются промежуточными продуктами в различных ферментативных реакциях. Так, например, пировиноградная кислота и другие α-кетокислоты реагируют с тиаминпирофосфатом, образуя соответствующие карбинолы — продукты присоединения, которые затем быстро декарбоксилируются и расщепляются, образуя альдегиды и исходный тиаминпирофосфат:
Ферменты[править | править код]
КФ 1.2.1.58 фенилглиоксалатдегидрогеназа (ацилирующая)
фенилглиоксалат + NAD+ + CoA-SH = бензоил-S-CoA + CO2 + NADH
КФ 1.2.2.2 пируватдегидрогеназа (цитохром)
пируват + феррицитохром b1 + H20 = ацетат + CO2 + феррицитохром b1
КФ 1.2.3.3 пируватоксидаза
пируват + фосфат + O2 = ацетилфосфат + CO2 + H2O2
КФ 1.2.4.1 пируватдегидрогеназа (липоамид)
Компонент пируватдегидрогназного комплекса
КФ 1.2.4.2 оксиглутаратдегидрогеназа (липоамид)
Компонент пируватдегидрогназного комплекса
КФ 1.2.4.4 3-метил-2-оксобутират дегидрогеназа (липоамид)
КФ 1.2.7.1 пируватсинтаза
КФ 1.2.7.7 2-оксоизовалерат ферредоксин редуктаза:
КФ 1.2.7.8 индолилпируват ферредоксин оксидоредуктаза:
КФ 1.2.7.9 2-оксоглутарат ферредоксин оксидоредуктаза
КФ 2.2.1.1 транскетолаза
sedoheptulose 7-фосфат + D-глицеральдегид 3-фосфат = D-рибозо 5-фосфат + D-ксилулозо 5-фосфат
КФ 2.2.1.3 формальдегид транскетолаза
D-ксилулозо-5-фосфат + формальдегид = глицеральдегид 3-фосфат + глицерон
КФ 2.2.1.4 ацетоин—рибозо-5-фосфат трансальдолаза
3-гидроксибутан-2-он + D-рибозо-5-фосфат = ацетальдегид + 1-дезокси-D-альтро-гептулозо-7-фосфат
КФ 2.2.1.5 2-гидрокси-3-оксоадипат синтаза
2-оксоглутарат + глиоксилат = 2-гидрокси-3-оксоадипат + CO2
КФ 2.2.1.6 ацетолактат синтаза
2 пируват = 2-ацетолактат + CO2
КФ 2.2.1.7 1-дезокси-D-ксилулозо-5-фосфат синтаза
пируват + D-глицеральдегид-3-фосфат = 1-дезокси-D-ксилулозо-5-фосфат + CO2
КФ 2.5.1.64 6-гидрокси-2-сукцинилциклогекса-2,4-диен-1-карбоксилат синтаза
2-оксоглутарат + изохоризмат (1S,6R)-6-гидрокси-2-сукцинилциклогекса-2,4-диен-1-карбоксилат + пируват + CO
КФ 2.7.4.15 тиамин-дифосфат киназа
ATP + тиамин дифосфат = ADP + тиамин трифосфат
КФ 2.7.4.16 тиамин-фосфат киназа
ATP + тиамин фосфат = ADP + тиамин дифосфат
КФ 2.7.6.2 тиамин дифосфокиназа
ATP + тиамин = AMP + тиамин дифосфат
КФ 3.6.1.15 нуклеозид-трифосфатаза
NTP + H20 = NDP + фосфат
КФ 3.6.1.28 тиамин-трифосфатаза
тиамин трифосфат + H20 = тиамин дифосфат + фосфат
КФ 4.1.1.1 пируват декарбоксилаза
2-оксокислота = альдегид + CO2
также катализирует образование ацилоинов из альдегидов
КФ 4.1.1.7 бензоилформиат декарбоксилаза
бензилформиат = бенегидзальд + CO2
КФ 4.1.1.8 оксалил-CoA декарбоксилаза
оксалил-CoA = формил-CoA + CO2
КФ 4.1.1.71 2-оксоглутарат декарбоксилаза
2-оксоглутарат =полуальдегид янтарной кислоты + CO2
КФ 4.1.1.74 индолилпируват декарбоксилаза
3-(индол-3-ил)пируват = 2-(индол-3-ил)ацетальдегид + CO2
КФ 4.1.1.75 5-гуанидино-2-оксопентаноат декарбоксилаза
5-гуанидино-2-оксо-пентаноат = 4-гуанидинобутаналь + CO2
КФ 4.1.1.79 сульфопируват декарбоксилаза
3-сульфоопируват = 2-сульфоацетальдегид + CO2
КФ 4.1.2.9 фосфокетолаза
D-ксилулозо-5-фосфат + фосфат = ацетилфосфат + D-глицеральдегид-3-фосфат + H20
КФ 4.1.2.38 бензоин альдолаза
2-гидрокси-1,2-дифенилэтанон = 2 бензальдегид
Медицинское применение[править | править код]
Применяется в медицине под названием «кокарбоксилаза». Синонимы: Berolase, Bioxilasi, B-Neuran, Cobilasi, Cocarbil, Cocarbosyl, Cocarboxylase, Coenzyme B, Cothiamine, Diphosphothiamin, Pyruvodehydrase и др.
Обычно кокарбоксилаза применяется как компонент комплексной терапии. Вводят её внутримышечно, иногда под кожу или внутривенно.[2]
Кокарбоксилаза уменьшает боли при стенокардии, оказывает антиаритмическое действие, уменьшает ацидоз при диабете.[1] Оказывает регулирующее воздействие на обменные процессы; снижает в организме уровень молочной и пировиноградной кислоты, улучшает усвоение глюкозы; улучшает трофику нервной ткани, способствует нормализации функции сердечно-сосудистой системы.[6]
По биологическому действию кокарбоксилаза отличается от тиамина, так, например, она неэффективна при бери-бери (В1-авитаминозе).[7]
Применяется в следующих случаях:[2][6][7]
- гипергликемическая кома, прекоматозное состояние и ацидоз при сахарном диабете
- ацидоз метаболический, дыхательный при хроническом сердечно-лёгочном синдроме
- дыхательная недостаточность
- нарушение сердечного ритма (экстрасистолия, бигеминия, пароксизмальная тахикардия, мерцательная аритмия)
- недостаточность печени или почек
- недостаточность коронарного кровообращения
- инфаркт миокарда
- легкие формы рассеянного склероза
- преэклампсические состояния
- эклампсия
- отравление алкоголем и хронический алкоголизм
- отравление наперстянкой, барбитуратами и другими метаболитами путём оксидации
- вспомогательно при дифтерите, скарлатине, тифе и паратифах
Для медицинского применения кокарбоксилаза выпускается в виде кокарбоксилазы гидрохлорида (0,05 г) для инъекций (Сocarboxylasi hydrochlridum 0,05 pro injectionibus). Представляет собой лиофилизированную сухую пористую массу белого цвета со слабым специфическим запахом. Препарат гигроскопичен, легко растворим в воде (рН 2,5 % раствора 1,2 — 1,9). Растворы готовят асептически непосредственно перед употреблением.[2]
Примечания[править | править код]
- ↑ 1 2 3 Кокарбоксилаза — статья из Большой советской энциклопедии (3-е издание)
- ↑ 1 2 3 4 Кокарбоксилаза
- ↑ Neuberg C., Karezag L. Biochemische Zeitschrift, 1911, 37, 170—176
- ↑ Jansen, B.C.P. and Donath, W.F. On the isolation of antiberiberi vitamin. Proc. Kon. Ned. Akad. Wet. 29: 1390—1400 (1926).
- ↑ Lohmann, K. and Schuster, P. Untersuchungen über die Cocarboxylase. Biochem. Z., 1937, 294, 188—214.
- ↑ 1 2 HELP med медицинский портал (недоступная ссылка)
- ↑ 1 2 Кокарбоксилаза
Источник
Витамин В1
(тиамин; антиневритный), как отмечалось, был первым кристаллическим витамином,
выделенным К. Функом в 1912 г. Позже был осуществлен его химический синтез.
Наряду с аминогруппой витамин B1 содержит атомы
серы, поэтому он был назван тиамином. В химической структуре его
содержатся два кольца – пиримидиновое и тиазоловое, соединенных метиленовой
связью. Обе кольцевые системы синтезируются отдельно в виде фосфорилированных
форм, затем объединяются через четвертичный атом азота.
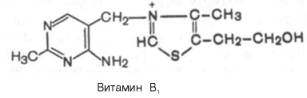
Тиамин хорошо
растворим в воде. Водные растворы тиамина в кислой среде выдерживают нагревание
до высоких температур без снижения биологической активности. В нейтральной и
особенно в щелочной среде витамин B1, наоборот,
быстро разрушается при нагревании. Этим объясняется частичное или даже полное
разрушение тиамина при кулинарной обработке пищи, например выпечке теста с
добавлением гидрокарбоната натрия или карбоната аммония. При окислении тиамина
образуется тио-хром, дающий синюю флюоресценцию при УФ-облучении. На этом
свойстве тиамина основано его количественное определение.
Витамин B1легко всасывается в кишечнике, но не накапливается в тканях и не
обладает токсическими свойствами. Избыток пищевого тиамина быстро выводится с
мочой. В превращении витамина B1в его активную
форму – тиаминпирофосфат (ТПФ), называемый также тиамин-дифосфатом (ТДФ),
участвует специфический АТФ-зависимый фермент тиаминпирофосфокиназа,
содержащаяся главным образом в печени и ткани мозга. Опытами с меченным 32Р
АТФ доказан перенос на тиамин целиком пирофосфатной группы в присутствии
фермента. ТПФ имеет следующее строение:
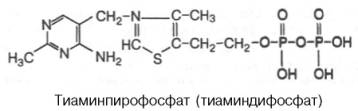
Если витамин B1поступает с пищей в виде ТПФ, то пирофосфатная группа отщепляется от
него под действием кишечных пирофосфатаз.
При отсутствии или недостаточности тиамина развивается тяжелое заболевание – бери-бери, широко распространенное в ряде
стран Азии и Индокитая, где основным продуктом питания является рис. Следует
отметить, что недостаточность витамина B1встречается
и в европейских странах, где она известна как симптом
Вернике, проявляющийся в виде энцефалопатии, или синдром Вейса с преимущественным
поражением сердечно-сосудистой системы. Специфические симптомы связаны с
преимущественными нарушениями деятельности и сердечно-сосудистой, и нервной
систем, а также пищеварительного тракта. В настоящее время пересматривается точка
зрения, что бери-бери у человека является следствием недостаточности только
витамина В1. Более
вероятно, что это заболевание представляет собой комбинированный авитаминоз или
полиавитаминоз, при котором организм испытывает недостаток также в рибофлавине,
пиридоксине, витаминах РР, С и др. На животных и добровольцах получен экспериментальный
авитаминоз Bl. В
зависимости от преобладания тех или иных симптомов различают ряд клинических
типов недостаточности, в частности полиневритную (сухую) форму бери-бери, при
которой на первый план выступают нарушения в периферической нервной системе.
При так называемой отечной форме бери-бери преимущественно поражается
сердечно-сосудистая система, хотя отмечаются также явления полиневрита.
Наконец, выделяют остро протекающую кардиальную форму болезни, называемую
пернициозной, которая приводит к летальному исходу в результате развития острой
сердечной недостаточности. В связи с внедрением в медицинскую практику
кристаллического препарата тиамина летальность резко сократилась и наметились
рациональные пути лечения и профилактики этого заболевания.
К наиболее
ранним симптомам авитаминоза В1 относятся нарушения моторной и
секреторной функций пищеварительного тракта: потеря аппетита, замедление
перистальтики (атония) кишечника, а также изменения психики, заключающиеся в
потере памяти на недавние события, склонности к галлюцинациям; отмечаются
изменения деятельности сердечно-сосудистой системы: одышка, сердцебиение, боли
в области сердца. При дальнейшем развитии авитаминоза выявляются симптомы
поражения периферической нервной системы (дегенеративные изменения нервных
окончаний и проводящих пучков), выражающиеся в расстройстве чувствительности,
ощущении покалывания, онемения и болей по ходу нервов. Эти поражения
завершаются контрактурами, атрофией и параличами нижних, а затем и верхних
конечностей. В этот же период развиваются явления сердечной недостаточности
(учащение ритма, сверлящие боли в области сердца). Биохимические нарушения при
авитаминозе В1 проявляются развитием отрицательного азотистого
баланса, выделением в повышенных количествах с мочой аминокислот и креатина,
накоплением в крови и тканях α-кетокислот, а также пентозосахаров.
Содержание тиамина и ТПФ в сердечной мышце и печени у больных бери-бери в 5-6
раз ниже нормы.
Биологическая роль. Экспериментально доказано, что витамин B1в форме ТПФ является составной часть минимум 5 ферментов, участвующих в
промежуточном обмене веществ. ТПФ входит в состав двух сложных ферментных
систем – пируват — и α — кетоглутарат дегидрогеназных комплексов, катализирующих окислительное
декарбоксилирование пировиноградной и
α-кетоглутаровой кислот. В составе транскетолазы ТПФ участвует в переносе
гликоальдегидного радикала от кетосахаров на альдосахара (см. главу 10). ТПФ
является коферментом пируватдекар-боксилазы клеток дрожжей (при алкогольной
ферментации) и дегидро-геназы γ-оксикетоглутаровой кислоты.
Приведенными
примерами, вероятнее всего, не ограничиваются биологические функции тиамина. В
частности, ТПФ участвует в окислительном декарбоксилировании глиоксиловой
кислоты и α-кетокислот, образующихся при распаде аминокислот с
разветвленной боковой цепью; в растениях ТПФ является эссенциальным кофактором
при синтезе валина и лейцина в составе фермента ацетолактатсинтетазы.
Распространение в природе и суточная потребность. Витамин В1 широко
распространен в природе. Основное количество его человек получает с
растительной пищей. Много витамина B1содержится
в дрожжах, пшеничном хлебе из муки грубого помола, оболочке и зародышах семян
хлебных злаков, сое, фасоли, горохе, меньше – в картофеле, моркови, капусте. Из
продуктов животного происхождения наиболее богаты витамином B1печень, почки, мозг. Некоторые бактерии, населяющие кишечник
животных, способны синтезировать достаточное количество тиамина: например,
количества витамина В1, синтезированного микрофлорой кишечника
коров, оказывается вполне достаточно для покрытия потребностей организма.
Рекомендуемые Институтом питания РАМН нормы суточного потребления тиамина для
отдельных групп населения составляют от 1,2 до 2,2 мг.

Источник
Витамин В1, был первым витамином, выделенным в кристаллическом виде К. Функом в 1912 г. Позже был осуществлен его химический синтез. Свое название — тиамин — получил из-за наличия в составе его молекулы атома серы и аминогруппы.
Тиамин состоит из 2-х гетероциклических колец — аминопиримидинового и тиазолового. Последнее содержит каталитически активную функциональную группу — карбанион (относительно кислый углерод между серой и азотом).
Тиамин хорошо сохраняется в кислой среде и выдерживает нагревание до высокой температуры. В щелочной среде, например при выпечке теста с добавлением соды или карбоната аммония, он быстро разрушается.
В желудочно-кишечном тракте различные формы витамина гидролизуются с образованием свободного тиамина. Большая часть тиамина всасывается в тонком кишечнике с помощью специфического механизма активного транспорта, остальное его количество расщепляется тиаминазой кишечных бактерий. С током крови всосавшийся тиамин попадает вначале в печень, где фосфорилируется тиаминпирофосфокиназой, а затем переносится в другие органы и ткани.
Существует мнение, что основной транспортной формой тиамина является ТМФ.
Витамин В1, присутствует в различных органах и тканях как в форме свободного тиамина, так и его фосфорных зфиров: тиаминмонофосфата(ТМФ), тиаминдифосфата (ТДФ, синонимы: тиамин пирофосфат, ТПФ, кокарбоксилаза) и тиаминтрифосфата (ТТФ).
ТТФ — синтезируется в митохондриях с помощью фермента ТПФ-АТФ-фосотрансферазы:
Основной коферментной формой (60—80 % от общего внутриклеточного) является ТПФ. ТТФ играет важную роль в метаболизме нервной ткани. При нарушении его образования развивается некротизирующая энцефалопатия. После распада коферментов свободный тиамин выделяется с мочой и определяется в виде тиохрома.
Витамин В, в форме ТПФ является составной частью ферментов, катализирующих реакции прямого и окислительного декарбоксилирования кетокислот.
Участие ТПФ в реакциях декарбоксилирования кетокислот объясняется необходимостью усиления отрицательного заряда углеродного атома карбонила кетокислоты в переходном, нестабильном, состоянии:
Переходное состояние стабилизируется ТПФ путем делокализаиии отрицательного заряда карбо-аниона тиазолового кольца, играющего роль своеобразного электронного стока. Вследствие такого протонирования образуется активный ацетальдегид (гидроксиэтил-ТПФ).
Аминокислотные остатки белков обладают слабой способностью осуществлять то, что с легкостью делает ТПФ, поэтому апобелки нуждаются в коферменте. ТПФ жестко связан с апоферментом мульти-ферментных комплексов дегидрогеназ а-оксикетокислот (см. ниже).
- Участие ТПФ в реакции прямого декарбоксилирования пировиноградной кислоты (ПВК).
При декарбоксилировании ПВК с помощью пируватдекарбоксилазы образуется ацетальдегид, который под воздействием алкогольдегидрогеназы превращается в этанол. ТПФ является незаменимым кофактором пируватдекарбоксилазы. Этим ферментом богаты дрожжи.
2. Участие ТПФ в реакциях окислительного декарбоксилирования.
Окислительное декарбоксилирование ПВК катализирует пируватде-гидрогеназа. В состав пируватдегидрогеназного комплекса входит несколько структурно связанных ферментных белков и коферментов (см. с. 100). ТПФ катализирует начальную реакцию декарбоксилирования ПВК. Эта реакция идентична катализируемой пируватдекарбоксила-зой. Однако в отличие от последней, пируватдегидрогеназа не превращает промежуточный продукт гидроксиэтил-ТПФ в ацетальдегид. Вместо этого гидроксиэтильная группа переносится к следующему ферменту в мультиферментной структуре пируватдегидрогеназного комплекса.
Окислительное декарбоксилирование ПВК является одной из ключевых реакций в обмене углеводов. В результате этой реакции ПВК, образовавшаяся при окислении глюкозы, включается в главный метаболический путь клетки — цикл Кребса, где окисляется до углекислоты и воды с выделением энергии. Таким образом, благодаря реакции окислительного декарбоксилирования ПВК создаются условия для полного окисления углеводов и утилизации всей заключенной в них энергии. Кроме того, образующаяся при действии ПДГ-комплек-са активная форма уксусной кислоты служит источником для синтеза многих биологических продуктов: жирных кислот, холестерина, стероидных гормонов, ацетоновых тел и других.
Окислительное дскарбоксилирование а-кетоглутатарата катализирует а-кетоглутаратдегидрогеназа. Этот фермент является составной частью цикла Кребса. Строение и механизм действия а-кетоглугарат-дегидрогеназного комплекса схожи с пируватдегидрогеназой, т. е. ТПФ также катализирует начальный этап превращения кетокислоты. Таким образом, от степени обеспеченности клетки ТПФ зависит бесперебойная работа этого цикла.
Помимо окислительных превращений ПВК и а-кетоглутарата, ТПФ принимает участие в окислительном декарбоксилировании кетокислот с разветвленным углеродным скелетом (продукты дезаминирования ва-лина, изолейцина и лейцина). Эти реакции играют важную роль в процессе утилизации аминокислот и, следовательно, белков клеткой.
3. ТПФ — кофермент транскетолазы.
Транскетолаза — фермент пентозофосфатного пути окисления углеводов. Физиологическая роль этого пути заключается в том, что он является основным поставщиком NADFH*H+ и рибозо-5-фосфата. Транскетолаза переносит дву-углеродные фрагменты от ксилулозо-5-фосфата к рибозо-5-фосфату,
что приводит к образованию триозофосфата (3-фосфоглицеринового альдегида) и 7С сахара (седогептулозо-7-фосфата). ТПФ необходим для стабилизации карб-аниона, образующегося при расщеплении связи С2-С3 ксилулозо-5-фосфата.
4. Витамин В1 принимает участие в синтезе ацетилхолина, катализируя в пируватдегидрогеназной реакции образование ацетил-КоА — субстрата ацетилирования холина.
5. Помимо участия в ферментативных реакциях, тиамин может выполнять и некоферментные функции, конкретный механизм которых еще нуждается в уточнении. Полагают, что тиамин участвует в кроветворении, на что указывает наличие врожденных тиаминзависимых анемий, поддающихся лечению высокими дозами этого витамина, а также в стероидогенезе. Последнее обстоятельство позволяет объяснить некоторые эффекты препаратов витамина В, как опосредованных стресс-реакцией.
Переходное состояние стабилизируется ТПФ путем дслокализаиии отрицательного заряда карб-аниона тиазолового кольца, играющего роль своеобразного электронного стока. Вследствие такого протонирования образуется активный ацетальдегид (гидроксиэтил-ТПФ).
Аминокислотные остатки белков обладают слабой способностью осуществлять то, что с легкостью делает ТПФ, поэтому апобелки нуждаются в коферменте. ТПФ жестко связан с апоферментом мульти-ферментных комплексов дегидрогеназ а-оксикетокислот (см. ниже).
Источник
