Какой витамин входит в состав над и надф

Название витамина PP дано от итальянского выражения preventive pellagra – предотвращающий пеллагру.
Источники
Хорошим источником являются печень, мясо, рыба, бобовые, гречка, черный хлеб. В молоке и яйцах витамина мало. Также синтезируется в организме из триптофана – одна из 60 молекул триптофана превращается в одну молекулу витамина.
Таким образом, можно считать, что 60 мг триптофана равноценны примерно 1 мг никотинамида. Если принять, что физиологическая норма потребления триптофана составляет 1 г, то в организме образуется около 17 мг никотинамида в сутки.
Суточная потребность
15-25 мг.
Строение
Витамин существует в виде никотиновой кислоты или никотинамида.

Две формы витамина РР
Его коферментными формами являются никотинамидадениндинуклеотид (НАД) и фосфорилированная по рибозе форма – никотинамидадениндинуклеотидфосфат (НАДФ).
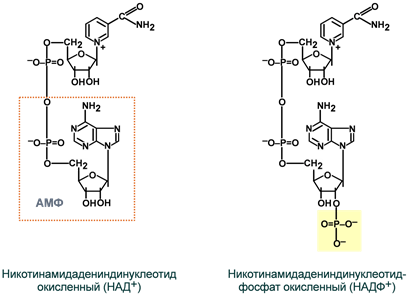
Строение окисленных форм НАД и НАДФ
Биохимические функции
Перенос гидрид-ионов Н– (атом водорода и электрон) в окислительно-восстановительных реакциях.
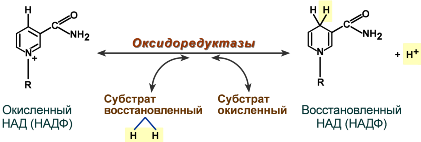
Механизм участия НАД и НАДФ в биохимической реакции
Благодаря переносу гидрид-иона витамин обеспечивает следующие задачи:
1. Метаболизм белков, жиров и углеводов. Так как НАД и НАДФ служат коферментами большинства дегидрогеназ, то они участвуют в реакциях
- при синтезе и окислении карбоновых кислот,
- при синтезе холестерола,
- обмена глутаминовой кислоты и других аминокислот,
- обмена углеводов: пентозофосфатный путь, гликолиз,
- окислительного декарбоксилирования пировиноградной кислоты,
- цикла трикарбоновых кислот.

Пример биохимической реакции с участием НАД
2. НАДН выполняет регулирующую функцию, поскольку является ингибитором некоторых реакций окисления, например, в цикле трикарбоновых кислот.
3. Защита наследственной информации – НАД является субстратом поли-АДФ-рибозилирования в процессе сшивки хромосомных разрывов и репарации ДНК.
4. Защита от свободных радикалов – НАДФН является необходимым компонентом антиоксидантной системы клетки.
5. НАДФН участвует в реакциях
- ресинтеза тетрагидрофолиевой кислоты (кофермент витамина B9) из дигидрофолиевой после синтеза тимидилмонофосфата,
- восстановления белка тиоредоксина при синтезе дезоксирибонуклеотидов,
- для активации «пищевого» витамина К или восстановления тиоредоксина после реактивации витамина К.
Гиповитаминоз B3
Причина
Пищевая недостаточность ниацина и триптофана. Синдром Хартнупа.
Клиническая картина
Проявляется заболеванием пеллагра (итал.: pelle agra – шершавая кожа) как синдром трех Д:
- дерматиты (фотодерматиты),
- диарея (слабость, расстройство пищеварения, потеря аппетита).
- деменция (нервные и психические расстройства, слабоумие),
При отсутствии лечения заболевание кончается летально. У детей при гиповитаминозе наблюдается замедление роста, похудание, анемия.
В США в 1912-1216 гг. число заболевших пеллагрой составляло 100 тысяч человек в год, из них около 10 тысяч умирало. Причиной являлось отсутствие животных продуктов питания, в основном люди питались кукурузой и сорго, которые бедны триптофаном и содержат неусвояемый связанный ниацин.
Интересно, что у индейцев Южной Америки, у которых с древних времен основу питания составляет кукуруза, пеллагра не встречается. Причиной такого феномена является то, что они отваривают кукурузу в известковой воде, при этом ниацин высвобождается из нерастворимого комплекса. Европейцы, взяв у индейцев кукурузу, не потрудились также позаимствовать и рецепты.
Антивитамины
Производное изоникотиновой кислоты изониазид, используемый для лечения туберкулеза. Механизм действия точно не выяснен, но по одной из гипотез – замена никотиновой кислоты в реакциях синтеза никотинамидаденин-динуклеотида (изо-НАД вместо НАД). В результате нарушается протекание окислительно-восстановительных реакций и подавляется синтез миколевой кислоты, структурного элемента клеточной стенки микобактерий туберкулеза.
Лекарственные формы
Никотинамид и никотиновая кислота.
Источник

Дегидрогеназы представляют собой энзимы класса оксидоредуктаз, которые катализируют реакции отщепления водорода (то есть протонов и электронов) от субстрата, который является окислителем, и транспортируют его на другой субстрат, который восстанавливается.
В зависимости от химической природы акцептора, с которым взаимодействуют дегидрогеназы, их делят на несколько групп:
- Анаэробные дегидрогеназы, которые катализируют реакции, в которых акцептором водорода является соединение, которое отличается от кислорода.
- Аэробные дегидрогеназы, которые катализируют реакции где акцептором водорода может быть кислород (оксидазы) или другой акцептор. Аэробные дегидрогеназы относятся к флавопротеинам, продукт реакции — перекись водорода.
- Дегидрогеназы, которые обеспечивают транспортировку электронов от субстрата к акцептору электронов. К этой группе дегидрогеназ принадлежат цитохромы дыхательной цепи митохондрий.
- Дегидрогеназы, которые катализируют прямое введение в молекулу субстрата окисляется, 1 или 2 атомов кислорода. Такие дегидрогеназы получили название оксигеназы.
Функцию первичных акцепторов атомов водорода, отщепляющихся от соответствующих субстратов, выполняют дегидрогеназы 2 типов:
- пиридинзависимые дегидрогеназы — содержат коферменты никотинамид (НАД +) или никотинамидадениндинуклеотидфосфат (НАДФ +).
- флавинзависимые дегидрогеназы, простетической группой которых является флавинадениндинуклеотид (ФАД) или флавинмононуклеотид (ФМН).
Коферменты НАДФ+ (или НАД+) с апоферментом связаны непрочно и поэтому могут в клетке находиться как в связанном с апоферментом состоянии, так и быть отделенными от белковой части.
Пиридинзависимые дегидрогеназы относятся к анаэробному типу — водорастворимые ферменты, окисляющие полярные субстраты. Реакции, катализируемой пиридинзависимыми дегидрогеназами, в общем виде приведены в таких уравнениях:
SH2 + НАДФ+ → S + НАДФН + Н+
SH2 + НАД+ → S + НАДН + Н+
Рабочей структурой в молекуле НАД + или НАДФ + является пиридиновое кольцо никотинамид, который присоединяет в ходе ферментативной реакции один атом водорода и один электрон (гидрид-ион), а второй протон поступает в реакционную среду. Пиридинзависимые дегидрогеназы очень распространены в живых клетках. Они отщепляющие протоны и электроны от многих субстратов, восстанавливая НАД + или НАДФ + и передавая в дальнейшем восстановительные эквиваленты на другие акцепторы. НАД-зависимые дегидрогеназы главным образом катализируют окислительно-восстановительные реакции окислительных путей метаболизма — гликолиза, цикла Кребса, β-окисления жирных кислот, дыхательной цепи митохондрий и др. НАД является главным источником электронов для цепи переноса электронов. НАДФ используется главным образом в процессах восстановительного синтеза (в синтезе жирных кислот и стероидов).
Флавинзависимые дегидрогеназы — флавопротеины, простетическими группами в которых ФАД или ФМН — производные витамина В2, которые прочно (ковалентно) связаны с апоферментом. Данные дегидрогеназы — мембраносвязанные ферменты, окисляющие неполярные и малополярные субстраты. Рабочей частью молекулы ФАД или ФМН, которая участвует в окислительно-восстановительных реакциях, является изоалоксазиновое кольцо рибофлавина, который акцептирует два атома водорода (2Н+ + 2е-) от субстрата.
Общее уравнение реакции с участием флавинзависимых дегидрогеназ выглядит так:
SH2 + ФМН → S + ФМН-Н2
SH2 + ФАД+ → S + ФАДН2
В процессах биологического окисления данные ферменты играют роль как анаэробных, так и аэробных дегидрогеназ. К, анаэробным дегидрогеназам принадлежит НАДН-дегидрогеназа, ФМН-зависимый фермент, который передает электроны от НАДН на более электроположительны компоненты дыхательной цепи митохондрий. Другие дегидрогеназы (ФАД-зависимые) переносят электроны непосредственно от субстрата на дыхательную цепь (например, сукцинатдегидрогеназа, ацил-КоА-дегидрогеназа). Транспортировка электронов от флавопротеинов к цитохромоксидазам в дыхательной цепи обеспечивают цитохромы, которые, кроме цитохромоксидазы, по классификации как анаэробные дегидрогеназы. Цитохромы – представляют собой железосодержащие протеины митохондрий — гемпротеины, которые за счет обратного изменения валентности геминового железа выполняют функцию транспортировки электронов в аэробных клетках непосредственно в цепях биологического окисления: цитохром (Fe3 +) + е → цитохром (Fe2 +).
В состав дыхательной цепи митохондрий входят цитохромы b, с1, с, а и а3 (цитохромоксидаза). Кроме дыхательной цепи, цитохромы содержатся в эндоплазматическом ретикулуме (450 и b5). К аэробным флавинзависимым дегидрогеназам принадлежат оксидазы L-аминокислот, ксантиноксидаза и др.
Дегидрогеназы, катализируют включение одного или двух атомов кислорода в молекулу субстрата, получили название оксигеназы. В зависимости от количества атомов кислорода, которые взаимодействуют с субстратом, оксигеназы делят на 2 группы:
- Диоксигеназы
- Монооксигеназы
Диоксигеназы катализируют присоединяет в молекулу субстрата 2 атомов кислорода: S + O2 → SO2. Это, в частности, негемовые железосодержащие ферменты, катализирующие реакции синтеза гомогентизиновой кислоты и ее окисления на пути катаболизма тирозина. Железосодержащая липооксигеназа катализирует включение О2 в арахидоновую кислоту, первую реакцию в процессе синтеза лейкотриенов. Пролин- и лизиндиоксигеназы катализируют реакции гидроксилирования остатков лизина и пролина в проколлагене. Монооксигеназы катализируют присоединение к субстрату только 1 из атомов молекулы кислорода. При этом, второй атом кислорода восстанавливается до воды:
SH + О2 + НАДФН + Н+
SОН + Н2О + НАДФ+
К монооксигеназам принадлежат ферменты, которые участвуют в обмене веществ многих лекарственных субстанций путем их гидроксилирования. Эти ферменты имеют локализацию преимущественно в микросомальной фракции печени, надпочечников, половых желез и других тканей. Поскольку чаще всего субстрат в монооксигеназных реакциях гидроксилируется, данную группу энзимов также называют гидроксилазы.
Монооксигеназы катализируют реакции гидроксилирования холестерина (стероидов) и превращение их в биологически активные субстанции, в том числе — половые гормоны, гормоны надпочечников, активные метаболиты витамина D — кальцитриол, а также реакции детоксикации путем гидроксилирования ряда токсичных веществ, лекарственных средств и продуктов их превращения для организма. Монооксигеназная мембранная система эндоплазматического ретикулума гепатоцитов содержит НАДФН + Н+, флавопротеины с кофактором ФАД, протеин (адренотоксин), содержащий негемовое железо, и гемпротеин — цитохром Р450. В результате гидроксилирования неполярных гидрофобных субстанций повышается их гидрофильность, что способствует инактивации биологически активных веществ или обезвреживанию токсичных субстанций и экскреции их из организма. Некоторые лекарственные субстанции, такие, как фенобарбитал, имеют способность индуцировать синтез микросомальных ферментов и цитохрома Р450.
Существуют монооксигеназы, которые не содержат цитохрома Р450. К ним относятся ферменты печени, которые катализируют реакции гидроксилирования фенилаланина, тирозина, триптофана.
^Наверх
Полезно знать
- D-димер – маркер фибринолиза (при беременности — норма, повышение — при тромбозах, ХСН, окологических процессах)
- Анаболические лекарственные средства – Анаболики – Анаболические препараты
- АПУД как нейроэндокринная система
Источник
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
— ковалентными связями;
— ионными связями;
— гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы– производные витаминов или химические модификации витаминов.
1 группа: тиаминовые – производные витамина В1. Сюда относят:
— тиаминмонофосфат (ТМФ);
— тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
— тиаминтрифосфат (ТТФ).
ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, a-кетоглутаровая кислота. Этот фермент катализирует отщепление СО2.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
— флавинмононуклеотид (ФМН);
— флавинадениндинуклеотид (ФАД).
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
[рис. изоалоксазиновое кольцо соединено с ребитолом, ребитол с фосфорной к-той, а фосфорная к-та – с АМФ]
ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2-COOH® (над стрелкой – СДГ, под – ФАД и ФАДН2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах.
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую.
4 группа: никотинамидные, производные витамина РР — никотинамида:
Представители:
— никотинамидадениндинуклеотид (НАД);
— никотинамидадениндинуклеотидфосфат (НАДФ).
Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2.
Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н+]
5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат]
— пиридоксин;
— пиридоксаль;
— пиридоксамин.
Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ).
ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК.
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH«(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu2+ — амилазы, Mg2+ — АТФ-азы (например, миозиновой АТФ-азы).
Могут участвовать в:
-присоединении субстратного комплекса фермента;
-в катализе;
-стабилизация оптимальной конформации активного центра фермента;
-стабилизация четвертичной структуры.
Источник
Àâòîð òåêñòà Àíèñèìîâà Åëåíà Ñåðãååâíà.
Àâòîðñêèå ïðàâà çàùèùåíû. Ïðîäàâàòü òåêñò íåëüçÿ.
Êóðñèâ ÍÅ ÍÓÆÍÎ çóáðèòü.
Çàìå÷àíèÿ ìîæíî ïðèñëàòü ïî ïî÷òå: exam_bch@mail.ru
https://vk.com/bch_5
ÏÀÐÀÃÐÀÔ 14:
«Âèòàìèí ÐÐ (íèàöèí).»
Ñì. ñíà÷àëà ï.9, 20-22, 26, 32, 45-48, 63, 65, 68, 72, 105, 106, 118, ôàéë «14 ÒÀÁËÈÖÀ».
Ñîäåðæàíèå ïàðàãðàôà:
14. 1. Îïðåäåëåíèå ÐÐ.
14. 2. Ñóòî÷íàÿ ïîòðåáíîñòü â ÐÐ.
14. 3. Ïèùåâûå èñòî÷íèêè ÐÐ.
14. 4. Àâèòàìèíîç ÐÐ (ÏÅËËÀÃÐÀ): ïîñëåäñòâèÿ è ïðèçíàêè àâèòàìèíîçà ÐÐ (â îáùåì)
14. 5. Êîôåðìåíòíûå ôîðìû ÐÐ. (Àêòèâíûå ôîðìû ÐÐ). Èõ îáðàçîâàíèå.
14. 6. Ôóíêöèè êîôåðìåíòà ÍÀÄ+ è ïîñëåäñòâèÿ èõ íàðóøåíèÿ.
14. 7. Ôóíêöèè êîôåðìåíòà ÍÀÄÔÍ è ïîñëåäñòâèÿ èõ íàðóøåíèÿ.
14. 1. Îïðåäåëåíèå.
Âèòàìèí ÐÐ èëè íèàöèí, èëè ïðîòèâîïåëëàãðè÷åñêèé («Ïðîòèâ Ïåëëàãðû»)
ýòî âåùåñòâà ÍÈÊÎÒÈÍÀÌÈÄ è íèêîòèíîâàÿ êèñëîòà.
ÐÐ ÷èòàåòñÿ êàê «ïýïý», à íå «ðýðý».
14. 2. Ñóòî÷íàÿ ïîòðåáíîñòü â ÐÐ
íåñêîëüêî ìèëëèãðàììîâ;
ïðè áåðåìåííîñòè, ñòðåññàõ, áîëüøèõ íàãðóçêàõ, ñíèæåííîé àêòèâíîñòè ôåðìåíòîâ àêòèâàöèè ÐÐ ïîòðåáíîñòü â ÐÐ ïîâûøåíà.
×òîáû ïîëó÷èòü ýòè íåñêîëüêî ìèëëèãðàììîâ ÐÐ íóæíî óïîòðåáëÿòü â äîñòàòî÷íûõ êîëè÷åñòâàõ:
14. 3. Ïèùåâûå èñòî÷íèêè ÐÐ:
æèâîòíûå ïðîäóêòû: ìÿñî, ÿéöà, ìîëî÷íûå ïðîäóêòû, ïå÷åíü, ðûáà, ñûð,
ðàñòèòåëüíûå ïðîäóêòû: áîáîâûå, îðåõè,
äðîææè è ò.ä.
Òàêèì îáðàçîì, ïðè ðàçíîîáðàçíîì ïîëíîöåííîì ïèòàíèè ÷åëîâåê ñ ïèùåé ïîëó÷àåò äîñòàòî÷íîå êîëè÷åñòâî âèòàìèíà ÐÐ.
Äåôèöèò ÐÐ â ïèùå âîçíèêàåò ïðè ïèòàíèè ìàêàðîíàìè, êàðòîøêîé, ÷èïñàìè, êîíôåòàìè è ò.ï..
ÐÐ äîëæåí íå òîëüêî ïîñòóïèòü ñ ïèùåé â ÆÊÒ, íî è âñîñàòüñÿ â ÆÊÒ (â òîíêîì êèøå÷íèêå). Ïîýòîìó ïîâðåæäåíèå êèøå÷íèêà ìîæåò ïðèâåñòè ê ñíèæåíèþ âñàñûâàíèÿ ÐÐ è ïðèâåñòè ê ïîÿâëåíèþ ñèìïòîìîâ äåôèöèòà ÐÐ.
Èç êèøå÷íèêà ÐÐ ïîñòóïàåò â ïå÷åíü,
èç ïå÷åíè ïîñòóïàåò â îáùèé êðîâîòîê, êîòîðûé òðàíñïîðòèðóåò âèòàìèí â òêàíè.
Íåäîñòàòîê ÐÐ ìîæåò êîìïåíñèðîâàòüñÿ íåçàìåíèìîé àìèíîêèñëîòîé òðèïòîôàíîì,
òàê êàê èç òðèïòîôàíà (ï.69.1) îáðàçóþòñÿ òå æå êîôåðìåíòû, ÷òî èç âèòàìèíà ÐÐ (ÍÀÄ+ è ÍÀÄÔ+). Íî îáû÷íî ïðè äåôèöèòå â ïèùå ïðîäóêòîâ, ñîäåðæàùèõ ÐÐ, íå õâàòàåò è òðèïòîôàíà, òàê êàê îí ñîäåðæèòñÿ â òåõ æå ïðîäóêòàõ, ÷òî è ÐÐ.
14. 4. Àâèòàìèíîç ÐÐ: ïîñëåäñòâèÿ è ïðèçíàêè àâèòàìèíîçà ÐÐ (â îáùåì)
ñõîäíû ñ ïîñëåäñòâèÿìè è ïðèçíàêàìè àâèòàìèíîçîâ Â1, Â2, ïàíòîòåíàòà, òî åñòü âèòàìèíîâ ÖÒÊ:
äåðìàòèòû,
àíåìèÿ,
íàðóøåíèå çàæèâëåíèÿ,
ñíèæåíèå èììóíèòåòà,
ñíèæåíèå âûíîñëèâîñòè,
ñíèæåíèå óìñòâåííîé ðàáîòîñïîñîáíîñòè, ïàìÿòè, êîíöåíòðàöèè âíèìàíèÿ.
Ñõîäñòâî ñèìïòîìîâ îáóñëîâëåíî òåì, ÷òî âñå ýòè âèòàìèíû íóæíû äëÿ ðàáîòû ÖÒÊ (ï.21) è äëÿ îáðàçîâàíèÿ íåéðîìåäèàòîðîâ.
Ñíèæåííàÿ ðàáîòîñïîñîáíîñòü îáóñëîâëåíà ñíèæåíèåì âûðàáîòêè ÀÒÔ,
îñòàëüíûå ñèìïòîìû îáóñëîâëåíû ñíèæåíèåì äåëåíèÿ êëåòîê è ñèíòåçà áåëêà èç-çà äåôèöèòà ÀÒÔ.
Ëå÷èòñÿ ýòî âñ¸ óïîòðåáëåíèåì ïèùè, êîòîðàÿ ñîäåðæèò ÐÐ è äðóãèå ïåðå÷èñëåííûå âèòàìèíû,
åñëè ïðè÷èíîé ïàòîëîãèé áûë äåôèöèò âèòàìèíîâ.
Ïðè÷èíîé ñèìïòîìîâ àâèòàìèíîçà ÐÐ ìîæåò áûòü íå äåôèöèò åãî â ïèùå, à íàðóøåíèå åãî àêòèâàöèè, òî åñòü ïðåâðàùåíèÿ â êîôåðìåíò (ñì. äàëåå).
Ï å ë ë à ã ð à .
Ñëîâîì «ïåëëàãðà» íàçûâàþò ñîñòîÿíèå îðãàíèçìà, êîòîðîå ðàçâèâàåòñÿ
ïðè îòñóòñòâèè â ïèùå âèòàìèíà ÐÐ èëè ïðè íàðóøåíèè ðàáîòû ÐÐ â îðãàíèçìå.
Íàïðèìåð, èç-çà ìóòàöèé â ãåíàõ, êîäèðóþùèõ ôåðìåíòû àêòèâàöèè ÐÐ.
Ëå÷èòñÿ ïåëëàãðà âêëþ÷åíèåì â ïèùó ÐÐ-ñîäåðæàùèõ ïðîäóêòîâ è àïòå÷íûìè ôîðìàìè ÐÐ.
Ïðè îòñóòñòâèè ëå÷åíèÿ ïåëëàãðû íàñòóïàåò ñìåðòü.
Ïðîÿâëåíèÿ ïåëëàãðû «3Ä»:
ÄÅÐÌÀÒÈÒ, ÄÈÀÐÅß, ÄÅÌÅÍÖÈß.
Äåìåíöèÿ ýòî íàðóøåíèå ìåíòàëüíîé (óìñòâåííîé) äåÿòåëüíîñòè. Ïðîÿâëÿåòñÿ ãàëëþöèíàöèÿìè, áðåäîì è ò.ä.
Ñëîâî «ïåëëàãðà» ïåðåâîäèòñÿ êàê «øåðøàâàÿ êîæà» — èìåëñÿ â âèäó äåðìàòèò.
14. 5. Êîôåðìåíòíûå ôîðìû ÐÐ. (Àêòèâíûå ôîðìû ÐÐ).
 êëåòêàõ ÐÐ äîëæåí ïðåâðàòèòüñÿ â êîôåðìåíòû ÍÀÄ+ è ÍÀÄÔ+,
êîòîðûå ó÷àñòâóþò â ðàáîòå ôåðìåíòîâ â êà÷åñòâå íåáåëêîâîãî êîìïîíåíòà ôåðìåíòîâ.
ÍÀÄ+ è ÍÀÄÔ+ ÿâëÿåòñÿ àêòèâíîé ôîðìîé ÐÐ,
à îáðàçîâàíèå ÍÀÄ+ ÿâëÿåòñÿ àêòèâàöèåé ÐÐ.
Ïðè ïðåâðàùåíèè ÐÐ â ÍÀÄ+ ê íèêîòèíàìèäó ïðèñîåäèíÿåòñÿ ðèáîçî-5-ôîñôàò,
îáðàçóÿ íóêëåîòèä ñ íèêîòèíàìèäîì â êà÷åñòâå àçîòèñòîãî îñíîâàíèÿ (ï.70),
à çàòåì ê ýòîìó íóêëåîòèäó ïðèñîåäèíÿåòñÿ äðóãîé íóêëåîòèä ÀÌÔ,
îáðàçóÿ äèíóêëåîòèä ñ îñíîâàíèÿìè íèêîòèíàìèä è àäåíèí, êîòîðûé íàçûâàåòñÿ:
ÍèêîòèíàìèäÀäåíèíÄèíóêëåîòèäîì, òî åñòü ÍÀÄ+.
Ïðèñîåäèíåíèå ôîñôàòà ê ÍÀÄ+ ïðèâîäèò ê åãî ïðåâðàùåíèþ â ÍÀÄÔ+.
(Ôîñôàò ïðèñîåäèíÿåòñÿ ïî âòîðîìó ïîëîæåíèþ ðèáîçû â ÀÌÔ).
«+» îçíà÷àåò, ÷òî ó âåùåñòâ ÍÀÄ+ è ÍÀÄÔ+ åñòü ïîëîæèòåëüíûé çàðÿä.
Ñïîñîá àêòèâàöèè ÐÐ ïðèñîåäèíåíèå íóêëåîòèäà (ÀÌÔ) è ôîñôàòà (ôîñôîðèëèðîâàíèå).
14. 6. Ôóíêöèè êîôåðìåíòà ÍÀÄ+ â îðãàíèçìå è ïîñëåäñòâèÿ èõ íàðóøåíèÿ.
(äàëåå ÍÀÄ)
Êðàòêî: ÍÀÄ+ (íàðÿäó ñ ðÿäîì äðóãèõ êîôåðìåíòîâ) íåîáõîäèì äëÿ ñèíòåçà ÀÒÔ,
ïîýòîìó ïðè äåôèöèòå ÐÐ ñèíòåç ÀÒÔ ñíèæàåòñÿ,
÷òî ïðèâîäèò ê ñëàáîñòè, ïîâðåæäåíèþ ìîçãà, ïî÷åê, ñåðäöà,
ñíèæåíèþ ñèíòåçà ÄÍÊ è äåëåíèÿ êëåòîê,
÷òî âåä¸ò ê äåðìàòèòàì, àíåìèÿì, ïîâðåæäåíèþ ÆÊÒ, ìåäëåííîìó çàæèâëåíèþ è ò.ä.
Êàê è êîôåðìåíòû ÍÀÄÔ+ è ÔÀÄ, êîôåðìåíò ÍÀÄ+ ó÷àñòâóåò â õèìè÷åñêèõ ðåàêöèÿõ
â êà÷åñòâå ïåðåíîñ÷èêà àòîìîâ âîäîðîäà.
Ôåðìåíòû ÄÅÃÈÄÐÎÃÅÍÀÇÛ (ÄÃ, ï. 3, 20) êàòàëèçèðóþò îòùåïëåíèå ïàðû àòîìîâ âîäîðîäà
(2Í: 2 ïðîòîíà è 2 ýëåêòðîíà) îò ðàçíûõ âåùåñòâ (ñóáñòðàòîâ),
ïîñëå ÷åãî ïðèñîåäèíÿþò ýòè îòùåïë¸ííûå îò ñóáñòðàòîâ àòîìû âîäîðîäà íà êîôåðìåíò ÍÀÄ+, ïðåâðàùàÿ åãî â ÍÀÄÍ, Í+.
(Ïðè ýòîì ê ÍÀÄ+ ïðèñîåäèíÿþòñÿ äâà ýëåêòðîíà è îäèí ïðîòîí, à âòîðîé ïðîòîí â ñðåäå îñòà¸òñÿ).
Îò ÍÀÄÍ âîäîðîä ïåðåíîñèòñÿ íà ÔÌÍ äûõàòåëüíîé öåïè (ï.22),
÷òî ïðèâîäèò Ê ÑÈÍÒÅÇÓ ÀÒÔ ñïîñîáîì îêèñëèòåëüíîãî ôîñôîðèëèðîâàíèÿ.
×àñòî êðàòêî ãîâîðÿò, ÷òî Äà «ïåðåíîñÿò âîäîðîä îò ñóáñòðàòîâ íà ÍÀÄ+ (ÔÀÄ, ÍÀÄÔ+)».
ÄÃ, êîòîðûì äëÿ ðàáîòû íóæåí ÍÀÄ+, íàçûâàþòñÿ ÍÀÄ+-çàâèñèìûìè.
Ïðè äåôèöèòå ÍÀÄ+:
ðàáîòà ÍÀÄ+-çàâèñèìûõ äåãèäðîãåíàç ñíèæàåòñÿ,
ïîýòîìó êàòàëèçèðóåìûå èìè ðåàêöèè çàìåäëÿþòñÿ,
÷òî ïðèâîäèò ê íàêîïëåíèþ ñóáñòðàòîâ ýòèõ ðåàêöèé è
ê äåôèöèòó ïðîäóêòîâ ðåàêöèé,
÷òî ïðèâîäèò ê óõóäøåíèþ ñàìî÷óâñòâèÿ, êëèíè÷åñêèì ïðîÿâëåíèÿì (àíàëèçû), à ïðè ñèëüíîì äåôèöèòå ÍÀÄ ê ñìåðòè.
Äåãèäðîãåíàçû, êîòîðûå èñïîëüçóþò ÍÀÄ+, ðàáîòàþò â îáìåíå âåùåñòâ âñåõ êëàññîâ:
1) óãëåâîäîâ (ãëèêîëèç, ôåðìåíò ôîñôîãëèöåðàëüäåãèä/äåãèäðîãåíàçà),
2) ëèïèäîâ (áåòà-îêèñëåíèå, ôåðìåíò àöèëÊîÀ/äåãèäðîãåíàçà),
3) áåëêîâ è àìèíîêèñëîò (îêèñëèòåëüíîå äåêàðáîêñèëèðîâàíèå, ôåðìåíò ãëóòàìàò-ÄÃ),
4) à òàêæå â ÖÒÊ è åãî «ïðåääâåðèè» (ÏÄÃ) ïóòè êàòàáîëèçìà, êîòîðûé ÿâëÿåòñÿ îáùèì äëÿ âåùåñòâ âñåõ êëàññîâ
(ôåðìåíòû èçîöèòðàò/äåãèäðîãåíàçà, êåòîãëóòàðàò/äåãèäðîãåíàçà, ìàëàò/äåãèäðîãåíàçà),
5) â îêèñëåíèè ýòàíîëà äî àöåòèëÊîÀ (ôåðìåíòû àëêîãîëü/äåãèäðîãåíàçà è àëüäåãèä/äåãèäðîãåíàçà),
6) â îêèñëåíèè âèòàìèíà äî ðåòèíàëÿ è ðåòèíàëÿ äî ãîðìîíà ðåòèíîàòà (ï.18).
Îñíîâíîå çíà÷åíèå ýòèõ äåãèäðîãåíàç ïîñòàâêà ÍÀÄÍ äëÿ äûõàòåëüíîé öåïè äëÿ ñèíòåçà ÀÒÔ.
Äåãèäðîãåíàçû îáìåíà ýòàíîëà îáåçâðåæèâàþò ýòàíîë,
äåãèäðîãåíàçû îáìåíà ðåòèíîëà äàþò ðåòèíàëü äëÿ çðåíèÿ è ðåòèíîàò äëÿ åãî ôóíêöèé.
ÀÒÔ íóæåí äëÿ ñèíòåçà ÄÍÊ è áåëêà,
à òàêæå äëÿ ðàáîòû êëåòîê, îñîáåííî àýðîáíûõ òêàíåé:
ãîëîâíîãî ìîçãà, ïå÷åíè, ïî÷åê, ñåðäöà è ò.ä.
Ïîýòîìó äåôèöèò ÀÒÔ ïðèâîäèò:
1. Ê íàðóøåíèþ ðàáîòû è ïîâðåæäåíèþ ãîëîâíîãî ìîçãà, ïî÷åê, ñåðäöà, ïå÷åíè, ñåò÷àòêè (ï.24);
â ÷àñòíîñòè, ýòî ïðèâîäèò ê ñëàáîñòè, ñíèæåíèþ óìñòâåííîé ðàáîòîñïîñîáíîñòè, ïàìÿòè, ôèçè÷åñêîé âûíîñëèâîñòè, çÿáêîñòè. È ò.ä.
2. Äåôèöèò ÀÒÔ ïðèâîäèò ê ÑÍÈÆÅÍÈÞ ÄÅËÅÍÈß ÊËÅÒÎÊ (ï.35 è 84), ÷òî ïðèâîäèò
ê íàðóøåíèþ ðåãåíåðàöèè ïðè ïîâðåæäåíèÿõ (îæîãàõ, ïîðåçàõ, ÿçâàõ, èíôàðêòå)
è ê íàðóøåíèþ ïîñòîÿííîãî îáíîâëåíèÿ òêàíåé, îñîáåííî ýïèòåëèàëüíûõ:
ýòî ïðèâîäèò ê:
äåðìàòèòàì,
àòðîôèè ñëèçèñòîé îáîëî÷êè ÆÊÒ (ýòî ïðèâîäèò ê äèàðåå),
ïîÿâëåíèþ ÿçâ ÆÊÒ, íàðóøåíèþ âñàñûâàíèÿ ïèòàòåëüíûõ âåùåñòâ, â òîì ÷èñëå âèòàìèíîâ («êðóã çàìêíóëñÿ»);
òàêæå ñíèæàåòñÿ êðîâåòâîðåíèå, ÷òî ïðèâîäèò ê äåôèöèòó êëåòîê êðîâè, à ýòî
ê àíåìèè (èç-çà äåôèöèòà ýðèòðîöèòîâ),
ñíèæåíèþ èììóíèòåòà (èç-çà äåôèöèòà ëåéêîöèòîâ).
Ñèëüíûé äåôèöèò ÀÒÔ ïðèâîäèò ê ÑÌÅÐÒÈ.
Ñèìïòîìû ñíèæåíèÿ ñèíòåçà áåëêà (è ÐÍÊ) ýòî
1) äåôèöèò ãåìîãëîáèíà (àíåìèÿ ¦ ãèïîêñèÿ ¦ äåôèöèò ÀÒÔ è òåïëà),
2) äåðìàòèòû êàê ïðîÿâëåíèå çàìåäëåíèÿ ðåãåíåðàöèè êëåòîê (äðóãèå ïðîÿâëåíèÿ ìåäëåííîå çàæèâëåíèå, àòðîôèÿ ñëèçèñòîé ÆÊÒ ¦ íàðóøåíèå ïèùåâàðåíèÿ è äð.),
3) äåôèöèò àíòèòåë (è ¦ ñíèæåíèå èììóíèòåòà),
4) äåôèöèò áåëêîâ ïëàçìû (îòåêè, ñíèæåíèÿ ñâîðà÷èâàåìîñòè êðîâè è äð. ïîñëåäñòâèÿ),
5) äåôèöèò ôåðìåíòîâ (è, ñëåäîâàòåëüíî, ñíèæåíèå ñêîðîñòè ðåàêöèé) è äð.
6) äåôèöèò áåëêîâ äëÿ ìåìáðàí (òî åñòü ìàòåðèàëîâ äëÿ ïîñòðîåíèÿ ìåìáðàí) ïðèâîäèò
ê ñèìïòîìàì ñíèæåíèÿ äåëåíèÿ êëåòîê (òàê êàê íîâûì êëåòêàì íóæíû ìåìáðàíû)
è ê ïîâðåæäåíèþ ìèåëèíîâûõ îáîëî÷åê (ýòî ïðèâîäèò ê íåâðîëîãè÷åñêèì ðàññòðîéñòâàì).
ÍÀÄ+ ó÷àñòâóåò íå òîëüêî â ïåðåíîñå àòîìîâ âîäîðîäà:
ýòîò êîôåðìåíò ìîæåò áûòü èñòî÷íèêîì ãðóïïû ÀÄÔ-ðèáîçà
â ïðîöåññàõ ïåðåíîñà ÀÄÔ-ðèáîçû îò íèêîòèíàìèäà íà áåëêè,
êîòîðûå íàçûâàþòñÿ ÀÄÔ-ðèáîçèëèðîâàåì áåëêîâ
è êàòàëèçèðóþòñÿ ôåðìåíòàìè, êîòîðûå íàçûâàþòñÿ ÀÄÔ-ðèáîçèë/òðàíñôåðàçàìè.
Ïðîöåññ ÀÄÔ-ðèáîçèëèðîâàíèÿ áåëêîâ îòíîñèòñÿ ê ïðîöåññàì ïîñòòðàíñëÿöèîííîé ìîäèôèêàöèè áåëêîâ ï.82.
14. 6. Ôóíêöèè êîôåðìåíòà ÍÀÄÔÍ â îðãàíèçìå è ïîñëåäñòâèÿ èõ íàðóøåíèÿ.
Êðàòêî: ÍÀÄÔÍ íåîáõîäèì äëÿ ðàáîòû ÀÍÒÈÎÊÈÑËÈÒÅËÜÍÎÉ ÑÈÑÒÅÌÛ (ï.27),
çàùèùàþùåé îò ñòàðåíèÿ è áîëåçíåé îêñèäàòèâíîé ìîäèôèêàöèè
ïîýòîìó ïðè äåôèöèòå ÐÐ óñêîðÿåòñÿ ÑÒÀÐÅÍÈÅ è ðàçâèòèå áîëåçíåé ÎÌÌ:
êàòàðàêòû, ãåìîëèòè÷åñêîé àíåìèè, àòåðîñêëåðîçà, äåãåíåðàòèâíûõ çàáîëåâàíèé è ò.ä.
Òàêæå ÍÀÄÔÍ íåîáõîäèì ÄËß ÑÈÍÒÅÇÀ ÄÍÊ (ï.72),
ïîýòîìó äåôèöèò ÐÐ ïðèâîäèò ê ñíèæåíèþ ñèíòåçà ÄÍÊ è äåëåíèÿ êëåòîê,
÷òî âåä¸ò ê äåðìàòèòàì, àíåìèÿì, ïîâðåæäåíèþ ÆÊÒ, ìåäëåííîìó çàæèâëåíèþ è ò.ä.
Êàê è êîôåðìåíòû ÍÀÄ+ è ÔÀÄ, êîôåðìåíò ÍÀÄÔ+ ó÷àñòâóåò â õèìè÷åñêèõ ðåàêöèÿõ
â êà÷åñòâå ïåðåíîñ÷èêà àòîìîâ âîäîðîäà.
Ôåðìåíòû ÄÅÃÈÄÐÎÃÅÍÀÇÛ (ÄÃ, ï. 3, 35) êàòàëèçèðóþò îòùåïëåíèå ïàðû àòîìîâ âîäîðîäà
(2Í: 2 ïðîòîíà è 2 ýëåêòðîíà) îò ìåòàáîëèòîâ ÏÔÏ,
ïîñëå ÷åãî ïðèñîåäèíÿþò ýòè îòùåïë¸ííûå àòîìû âîäîðîäà íà êîôåðìåíò ÍÀÄÔ+, ïðåâðàùàÿ åãî â ÍÀÄÔÍ, Í+.
(Ïðè ýòîì ê ÍÀÄÔ+ ïðèñîåäèíÿþòñÿ äâà ýëåêòðîíà è îäèí ïðîòîí, à âòîðîé ïðîòîí â ñðåäå îñòà¸òñÿ).
Îò ÍÀÄÔÍ âîäîðîä ïåðåíîñèòñÿ íå â äûõàòåëüíóþ öåïü, êàê îò ÍÀÄÍ,
à íà îêèñëåííûé ãëóòàòèîí (GSSG),
ïðåâðàùàÿ åãî â âîññòàíîâëåííûé ãëóòàòèîí (2GSH),
÷òî íåîáõîäèìî äëÿ ðàáîòû àíòèîêèñëèòåëüíîé ñèñòåìû è äëÿ ñèíòåçà ÄÍÊ (ñ.72).
Ïåðåíîñ âîäîðîäà îò ÍÀÄÔÍ íà ãëóòàòèîí êàòàëèçèðóåò ôåðìåíò ãëóòàòèîí/ðåäóêòàçà,
êîòîðîìó, êðîìå ÍÀÄÔÍ, íóæåí ÔÀÄ (ñ Â2).
Êðîìå òîãî, ÍÀÄÔÍ ó÷àñòâóåò â ñèíòåçå æèðíûõ êèñëîò äëÿ ìåìáðàííûõ ëèïèäîâ è â ñèíòåçå õîëåñòåðèíà.
Ôåðìåíòû, êîòîðûì äëÿ ðàáîòû íóæåí ÍÀÄÔÍ+, íàçûâàþòñÿ ÍÀÄÔÍ-çàâèñèìûìè.
Ïðè äåôèöèòå ÍÀÄÔÍ:
ðàáîòà ÍÀÄÔÍ-çàâèñèìûõ ôåðìåíòîâ ñíèæàåòñÿ,
ïîýòîìó êàòàëèçèðóåìûå èìè ðåàêöèè çàìåäëÿþòñÿ,
÷òî ïðèâîäèò ê íàêîïëåíèþ ñóáñòðàòîâ ýòèõ ðåàêöèé è
ê äåôèöèòó ïðîäóêòîâ ðåàêöèé,
÷òî ïðèâîäèò ê óõóäøåíèþ ñàìî÷óâñòâèÿ, êëèíè÷åñêèì ïðîÿâëåíèÿì (àíàëèçû), à ïðè ñèëüíîì äåôèöèòå ÍÀÄÔÍ ê ñìåðòè.
Ôåðìåíòû, îáðàçóþùèå ÍÀÄÔÍ èç ÍÀÄÔ:
äåãèäðîãåíàçû, êîòîðûå èñïîëüçóþò ÍÀÄÔ+ è ïðåâðàùàþò ÍÀÄÔ+ â ÍÀÄÔÍ,
ðàáîòàþò â ïåíòîçîôîñôàòíîì ïóòè,
îíè îòùåïëÿþò âîäîðîä îò ìåòàáîëèòîâ ãëþêîçî-6-ôîñôàò (ãëþêîçî-6-ôîñôàò/äåãèäðîãåíàçà) è 6-ôîñôîãëþêîíàò (6-ôîñôîãëþêîíàò/äåãèäðîãåíàçà)
è ïåðåíîñÿò îòùåïë¸ííûå àòîìû âîäîðîäà íà ÍÀÄÔ+, ïðåâðàùàÿ åãî â ÍÀÄÔÍ.
Ôåðìåíòû, èñïîëüçóþùèå ÍÀÄÔÍ (ÍÀÄÔÍ-çàâèñèìûå ôåðåíòû):
1) ðåäóêòàçû,
2) ãèäðîêñèëàçû,
3) òðàíñãèäðîãåíàçà (ïåðåíîñèò âîäîðîä îò ÍÀÄÔÍ íà ÍÀÄ, îáðàçóÿ ÍÀÄÍ äëÿ ÄÖ) è
4) êåòîãëóòàðàò/äåãèäðîãåíàçà, ïðåâðàùàþùàÿ êåòîãëóòàðàò â ãëóòàìàò ï.65.
Ðåäóêòàçû, èñïîëüçóþùèå ÍÀÄÔÍ:
1) Ãëóòàòèîíðåäóêòàçà,
2) òèîðåäîêñèí/ðåäóêòàçà,
3) ôîëàòðåäóêòàçà,
4) äèãèäðîôîëàòðåäóêòàçà,
5) åíîèëÀÏÄ/ðåäóêòàçà,
6) áåòà-êåòîàöèëÏÄ/ðåäóêòàçà,
7) ÃÌÃ-ÊîÀ/ðåäóêòàçà.
Ãèäðîêñèëàçû, èñïîëüçóþùèå ÍÀÄÔÍ:
1) Ôåíèëàëàíèí/ãèäðîêñèëàçà,
2) òèðîçèí/ãèäðîêñèëàçà,
3) òðèïòîôàí/ãèäðîêñèëàçà,
4) êàëüöèîë/ãèäðîêñèëàçà,
5) êàëüöèÄÈîë/ãèäðîêñèëàçà,
6) ãèäðîêñèëàçû, ó÷àñòâóþùèå â ñèíòåçå ñòåðîèäíûõ ãîðìîíîâ è æåë÷íûõ êèñëîò.
(1-3 àðîìàòè÷åñêèå àìèíîêèñëîòû, 4-6 îáìåí ñòåðîèäîâ (ï.40, 44, 117, 107))
(Ïîäðîáíåå)
1. Ãëóòàòèîí/ðåäóêòàçà (ï.27 è 72)
êàòàëèçèðóåò ïåðåíîñ âîäîðîäà îò ÍÀÄÔÍ íà ãëóòàòèîí îêèñëåííûé (GSSG),
ïðåâðàùàÿ åãî â ãëóòàòèîí âîññòàíîâëåííûé (GSH).
Êðîìå ÐÐ, äëÿ ðàáîòû ýòîãî ôåðìåíòà íóæåí âèòàìèí Â2 (â ñîñòàâå êîôàêòîðà ÔÀÄ).
Ãëóòàòèîí âîññòàíîâëåííûé íóæåí äëÿ ðàáîòû àíòèîêèñëèòåëüíîé ñèñòåìû
(äëÿ ôåðìåíòîâ ãëóòàòèîí/ïåðîêñèäàçà è ãëóòàòèîí/òðàíñôåðàçà),
à òàêæå äëÿ ñèíòåçà ÄÍÊ (ï.72): ñì. íóêëåîòèäðåäóêòàçó.
Ïðè äåôèöèòå ÐÐ (à òàêæå ïðè äåôèöèòå Â1, Â2, èíñóëèíà è ãëþêîçû)
êîôåðìåíòà ÍÀÄÔÍ íå õâàòàåò,
÷òî ïðèâîäèò ê ñíèæåíèþ àêòèâíîñòè ãëóòàòèîíðåäóêòàçû,
÷òî ïðèâîäèò ê äåôèöèòó ãëóòàòèîíà âîññòàíîâëåííîãî,
÷òî ïðèâîäèò ê íàðóøåíèþ ðàáîòû àíòèîêèñëèòåëüíîé ñèñòåìû (ÀÎÑ) è ñèíòåçà ÄÍÊ
(ñì. âûøå î ïîñëåäñòâèÿõ ñíèæåíèÿ ñèíòåçà ÄÍÊ).
Ñíèæåíèå ðàáîòû ÀÎÑ ïðèâîäèò ê óñêîðåíèþ:
ÑÒÀÐÅÍÈß,
ðàçâèòèÿ ÊÀÒÀÐÀÊÒÛ,
ðàçâèòèÿ àòåðîñêëåðîçà ñ åãî ðèñêàìè èíôàðêòà è èíñóëüòà,
ðàçâèòèÿ íåéðîäåãåíåðàòèâíûõ çàáîëåâàíèé,
ïîâûøàåò ðèñê ðàçâèòèÿ îíêîëîãè÷åñêèõ çàáîëåâàíèé è ò.ä.
2. Òèîðåäîêñèí/ðåäóêòàçà (ï.72)
êàòàëèçèðóåò ïåðåíîñ âîäîðîäà îò ÍÀÄÔÍ íà òèîðåäîêñèí îêèñëåííûé (TSS),
ïðåâðàùàÿ åãî â òèîðåäîêñèí âîññòàíîâëåííûé (T(SH)2).
Êðîìå ÐÐ, äëÿ ðàáîòû ýòîãî ôåðìåíòà íóæåí âèòàìèí Â2 (â ñîñòàâå êîôàêòîðà ÔÀÄ).
Òèîðåäîêñèí âîññòàíîâëåííûé íóæåí äëÿ ñèíòåçà ÄÍÊ (ï.72): ñì. íóêëåîòèäðåäóêòàçó.
Ïðè äåôèöèòå ÐÐ (à òàêæå ïðè äåôèöèòå Â1, èíñóëèíà è ãëþêîçû)
êîôåðìåíòà ÍÀÄÔÍ íå õâàòàåò,
÷òî ïðèâîäèò ê ñíèæåíèþ àêòèâíîñòè òèîðåäîêñèí/ðåäóêòàçû,
÷òî ïðèâîäèò ê ñíèæåíèþ ñèíòåçà ÄÍÊ
(ñì. âûøå î ïîñëåäñòâèÿõ ñíèæåíèÿ ñèíòåçà ÄÍÊ).
3. Ôîëàò/ðåäóêòàçà (ï.16)
êàòàëèçèðóåò ïåðåíîñ âîäîðîäà îò ÍÀÄÔÍ íà ôîëàò,
ïðåâðàùàÿ ôîëàò â äèãèäðîôîëàò.
4. Äèãèäðîôîëàò/ðåäóêòàçà
êàòàëèçèðóåò ïåðåíîñ âîäîðîä îò ÍÀÄÔÍ íà äèãèäðîôîëàò,
ïðåâðàùàÿ åãî â òåòðàãèäðî/ôîëàò (ÒÃÔ).
ÒÃÔ íóæåí äëÿ ñèíòåçà ÄÍÊ (ï.72) è ïðîöåññîâ òðàíñìåòèëèðîâàíèÿ (ï.68.2).
Ïðè äåôèöèòå ÐÐ (à òàêæå ïðè äåôèöèòå Â1, èíñóëèíà è ãëþêîçû)
êîôåðìåíòà ÍÀÄÔÍ íå õâàòàåò, ÷òî ïðèâîäèò ê íàðóøåíèþ ïðåâðàùåíèÿ ôîëàòà â ÒÃÔ,
÷òî ïðèâîäèò ê ñíèæåíèþ ñèíòåçà ÄÍÊ (ñì. âûøå î ïîñëåäñòâèÿõ ñíèæåíèÿ ñèíòåçà ÄÍÊ)
è ïðîöåññîâ òðàíñìåòèëèðîâàíèÿ.
5. ÃÌÃ-ÊîÀ/ðåäóêòàçà (ï.48)
êàòàëèçèðóåò ïåðåíîñèò âîäîðîäà îò (äâóõ ìîëåêóë) ÍÀÄÔÍ íà ÃÌÃ-ÊîÀ,
ïðåâðàùàÿ åãî â ìåâàëîíîâóþ êèñëîòó (ìåâàëîíàò),
÷òî äàëåå ïðèâîäèò ê îáðàçîâàíèþ õîëåñòåðèíà,
íåîáõîäèìîãî äëÿ îáðàçîâàíèÿ ìåìáðàí ïðè äåëåíèè êëåòîê,
à òàêæå äëÿ ñèíòåçà ñòåðîèäîâ: ãîðìîíîâ, æåë÷íûõ êèñëîò, âèòàìèíà Ä.
6. ÅíîèëÀÏÁ/ðåäóêòàçà è áåòà-êåòîàöèëÀÏÁ/ðåäóêòàçà
êàòàëèçèðóþò ïåðåíîñ âîäîðîäà îò ÍÀÄÔÍ íà åíîèëÀÏÁ è áåòà-êåòîàöèëÀÏÁ,
ïðåâðàùàÿ èõ â àöèëÀÏÁ è áåòà-ãèäðîêñèàöèëÀÏÁ,
÷òî äàëåå ïðèâîäèò ê îáðàçîâàíèþ æèðíûõ êèñëîò,
â òîì ÷èñëå äëÿ îáðàçîâàíèÿ ìåìáðàííûõ ëèïèäîâ ï.52.
7. Ôåíèëàëàíèí/ãèäðîêñèëàçà (ï.63, 68, ï.26)
êàòàëèçèðóåò ãèäðîêñèëèðîâàíèå ôåíèëàëàíèíà,
÷òî ïðèâîäèò ê ïðåâðàùåíèþ ôåíèëàëàíèíà â òèðîçèí,
÷òî âàæíî íå ñòîëüêî êàê ñïîñîá ïîëó÷åíèÿ òèðîçèíà (òèðîçèíà äîñòàòî÷íî è â ïèùå),
ñêîëüêî êàê ñïîñîá ñíèçèòü êîíöåíòðàöèþ ôåíèëàëàíèíà,
êîòîðûé ñïîñîáåí ïîâðåæäàòü íåðâíûå êëåòêè,
÷òî èìååò ìåñòî è ïðè ôåíèëêåòîíóðèè (ï.68), è ïðè äåôèöèòå ÐÐ.
Ïðè äåôèöèòå âèòàìèíà ÐÐ è òðèïòîôàíà, âèòàìèíà Â1 êîôåðìåíòà ÍÀÄÔÍ íå õâàòàåò,
÷òî ïðèâîäèò ê èçáûòêó ôåíèëàëàíèíà è ïîâðåæäåíèþ íåðâíûõ êëåòîê.
8. Òèðîçèí/ãèäðîêñèëàçà (ï.68, 105)
êàòàëèçèðóåò ãèäðîêñèëèðîâàíèå òèðîçèíà,
÷òî ïðèâîäèò ê ïðåâðàùåíèþ òèðîçèíà â ÄÎÔÀ,
÷òî íåîáõîäèìî äëÿ ñèíòåçà èç ÄÎÔÀ:
ïèãìåíòà ìåëàíèíà, çàùèùàþùåãî îò óëüòðàôèîëåòà, à òàêæå
äëÿ ñèíòåçà êàòåõîëàìèíîâ: ÄÎÔÀÌÈÍÀ, ÍÎÐÀÄÐÅÍÀËÈÍÀ è àäðåíàëèíà.
Ïðè äåôèöèòå ÐÐ âîçíèêàåò äåôèöèò ÍÀÄÔÍ,
÷òî ïðèâîäèò ê ñíèæåíèþ ñèíòåçà êàòåõîëàìèíîâ,
÷òî ïðèâîäèò ê ÄÅÏÐÅÑÑÈÈ, ñíèæåíèþ óìñòâåííîé ðàáîòîñïîñîáíîñòè è íàðóøåíèþ ÂÍÄ.
9. Òðèïòîôàí/ãèäðîêñèëàçà (ï.63)
êàòàëèçèðóåò ãèäðîêñèëèðîâàíèå òðèïòîôàíà,
÷òî ïðèâîäèò ê ïðåâðàùåíèþ òðèïòîôàíà â 5-ãèäðîêñè/òðèïòîôàí,
÷òî íåîáõîäèìî äëÿ ñèíòåçà èç íåãî ÑÅÐÎÒÎÍÈÍÀ è ìåëàòîíèíà.
Ïðè äåôèöèòå ÐÐ âîçíèêàåò äåôèöèò ÍÀÄÔÍ,
÷òî ïðèâîäèò ê ñíèæåíèþ ñèíòåçà ñåðîòîíèíà è ìåëàòîíèíà,
÷òî ïðèâîäèò ê ÄÅÏÐÅÑÑÈÈ, ñíèæåíèþ óìñòâåííîé ðàáîòîñïîñîáíîñòè è íàðóøåíèþ ÂÍÄ.
10. Êàëüöèîë/ãèäðîêñèëàçà è êàëüöèÄÈîë/ãèäðîêñèëàçà
êàòàëèçèðóþò ãèäðîêñèëèðîâàíèå êàëüöèîëà è êàëüöèäèîëà (ñîîòâåòñòâåííî),
÷òî ïðèâîäèò ê ïðåâðàùåíèþ êàëüöèîëà (âèòàìèíà Ä) â êàëüöèÄÈîë,
à çàòåì êàëüöèÄÈîëà â êàëüöèÒÐÈîë ÃÎÐÌÎÍ, àêòèâíóþ ôîðìó âèòàìèíà Ä,
íåîáõîäèìîãî äëÿ ïðî÷íîñòè êîñòåé, òîíóñà ìûøö è ò.ä. ï.114.
Ïðè äåôèöèòå ÐÐ âîçíèêàåò äåôèöèò ÍÀÄÔÍ,
÷òî ïðèâîäèò ê ñíèæåíèþ àêòèâàöèè âèòàìèíà Ä,
÷òî ñïîñîáñòâóåò ðàõèòó, îñòåîïîðîçó è ò.ä.
Источник
