Какой витамин входит в состав коферментов над и надф
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
— ковалентными связями;
— ионными связями;
— гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы– производные витаминов или химические модификации витаминов.
1 группа: тиаминовые – производные витамина В1. Сюда относят:
— тиаминмонофосфат (ТМФ);
— тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
— тиаминтрифосфат (ТТФ).
ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, a-кетоглутаровая кислота. Этот фермент катализирует отщепление СО2.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
— флавинмононуклеотид (ФМН);
— флавинадениндинуклеотид (ФАД).
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
[рис. изоалоксазиновое кольцо соединено с ребитолом, ребитол с фосфорной к-той, а фосфорная к-та – с АМФ]
ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2-COOH® (над стрелкой – СДГ, под – ФАД и ФАДН2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах.
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую.
4 группа: никотинамидные, производные витамина РР — никотинамида:
Представители:
— никотинамидадениндинуклеотид (НАД);
— никотинамидадениндинуклеотидфосфат (НАДФ).
Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2.
Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н+]
5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат]
— пиридоксин;
— пиридоксаль;
— пиридоксамин.
Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ).
ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК.
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH«(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu2+ — амилазы, Mg2+ — АТФ-азы (например, миозиновой АТФ-азы).
Могут участвовать в:
-присоединении субстратного комплекса фермента;
-в катализе;
-стабилизация оптимальной конформации активного центра фермента;
-стабилизация четвертичной структуры.
Источник
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
— ковалентными связями;
— ионными связями;
— гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы – производные витаминов или химические модификации витаминов.
1 группа: тиаминовые
– производные витамина В1. Сюда относят:
— тиаминмонофосфат (ТМФ);
— тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
— тиаминтрифосфат (ТТФ).
ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, a-кетоглутаровая кислота. Этот фермент катализирует отщепление СО2.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
— флавинмононуклеотид (ФМН);
— флавинадениндинуклеотид (ФАД).
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. . Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах.
![]()
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую.
4 группа: никотинамидные, производные витамина РР — никотинамида:
Представители:
— никотинамидадениндинуклеотид (НАД);
— никотинамидадениндинуклеотидфосфат (НАДФ).
Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2.
Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н+]
5 группа: пиридоксиновые, производные витамина В6.
— пиридоксин;
— пиридоксаль;
— пиридоксамин.
Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ).
ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК.
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды
– УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH«(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu2+ — амилазы, Mg2+ — АТФ-азы (например, миозиновой АТФ-азы).
Могут участвовать в:
-присоединении субстратного комплекса фермента;
-в катализе;
-стабилизация оптимальной конформации активного центра фермента;
-стабилизация четвертичной структуры.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 19 апреля 2017;
проверки требуют 12 правок.
| Кофермент A | |
|---|---|
| Систематическое наименование | '»`UNIQ--nowiki-00000000-QINU`»‘ |
| Традиционные названия | кофермент A |
| Хим. формула | C21H36N7O16P3S |
| Молярная масса | 767,534 ± 0,031 г/моль |
| Рег. номер CAS | 85-61-0 |
| PubChem | 68163312 |
| Рег. номер EINECS | 201-619-0 |
| SMILES | O=C(NCCS)CCNC(=O)C(O)C(C)(C)COP(=O)(O)OP(=O)(O)OC[C@H]3O[C@@H](n2cnc1c(ncnc12)N)[C@H](O)[C@@H]3OP(=O)(O)O |
| InChI | 1S/C21H36N7O16P3S/c1-21(2,16(31)19(32)24-4-3-12(29)23-5-6-48)8-41-47(38,39)44-46(36,37)40-7-11-15(43-45(33,34)35)14(30)20(42-11)28-10-27-13-17(22)25-9-26-18(13)28/h9-11,14-16,20,30-31,48H,3-8H2,1-2H3,(H,23,29)(H,24,32)(H,36,37)(H,38,39)(H2,22,25,26)(H2,33,34,35)/t11-,14-,15-,16?,20-/m1/s1 RGJOEKWQDUBAIZ-DRCCLKDXSA-N |
| ChEBI | 15346 |
| ChemSpider | 6557 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
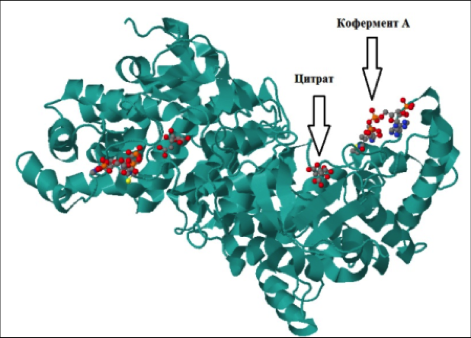
Кофермент A (коэнзим A, КоA, СоА, HSKoA) — кофермент ацетилирования; один из важнейших коферментов, принимающий участие в реакциях переноса ацильных групп при синтезе и окислении жирных кислот и окислении пирувата в цикле лимонной кислоты.[1]
Строение[править | править код]
Молекула кофермента A состоит из остатка адениловой кислоты (1), связанной пирофосфатной группой (2) с остатком пантоевой кислоты (3), которая в свою очередь связана амидной связью с аминокислотой β-аланином (4) (эти две группы представляют собой остаток пантотеновой кислоты), соединённой амидной связью с остатком β-меркаптоэтаноламина (5).
Биосинтез[править | править код]
Кофермент A синтезируется в пять этапов из пантотеновой кислоты (витамина B5) и цистеина:
- Пантотеновая кислота фосфорилируется в 4′-фосфопантотенат с помощью фермента пантотенаткиназы
- Цистеин присоединяется к 4′-фосфопантотенату с помощью фермента фосфопантотеноилцистеинсинтетазы с образованием 4′-фосфо-N-пантотеноилцистеина
- 4′-фосфо-N-пантотеноилцистеин декарбоксилируется с образованием 4′-фосфопантотеина с помощью фермента фосфопантотеноилцистеиндекарбоксилазы
- 4′-фосфопантотеин с адениловой кислотой формирует дефосфо-КоA под действием фермента фосфопантотеинаденилтрансферазы
- Наконец, дефосфо-КоA фосфорилируется АТФ в кофермент A с помощью фермента дефосфокоэнзимкиназы.
Биохимическая роль[править | править код]
С КоА связан ряд биохимических реакций, лежащих в основе окисления и синтеза жирных кислот, биосинтеза жиров, окислительных превращений продуктов распада углеводов. Во всех случаях КоA действует в качестве промежуточного звена, связывающего и переносящего кислотные остатки на другие вещества. При этом кислотные остатки в составе соединения с КоA подвергаются тем или иным превращениям, либо передаются без изменений на определённые метаболиты.
История открытия[править | править код]
Впервые кофермент был выделен из печени голубя в 1947 году Ф. Липманом[2]. Структура кофермента A была определена в начале 1950-х годов Ф. Линеном в Институте Листера в Лондоне. Полный синтез КоA осуществил в 1961 году X. Корана.
Список ацил-КоA[править | править код]
Из природных соединений выделены и идентифицированы различные ацильные производные кофермента A:
Ацил-КоA из карбоновых кислот:
- Ацетил-КоА
- Пропионил-КоА
- Ацетоацетил-КоА
- Кумарол-КоА
- Бутирил-КоА
Ацил-КоА из дикарбоновых кислот:
- Малонил-КоА
- Сукцинил-КоА
- Гидроксиметилглютарил-КоА
- Пименил-КоА
Ацил-КоА из карбоциклических кислот:
- Бензоил-КоА
- Фенилацетил-КоА
Существуют также разнообразные ацил-КоА жирных кислот, которые играют большую роль в качестве субстратов для реакций синтеза липидов.
См. также[править | править код]
- Витамин B5
Примечания[править | править код]
- ↑ Овчинников Ю. А. Биоорганическая химия / Ю. А. Овчинников. — М.: Просвещение, 1987. — 815 с., ил.
- ↑ Baddiley, J.; Thain, E. M.; Novelli, G. D.; Lipmann, F. Structure of Coenzyme A (англ.) // Nature : journal. — 1953. — Vol. 171, no. 4341. — P. 76. — doi:10.1038/171076a0.
Литература[править | править код]
- Филиппович, Ю. Б. Основы биохимии: Учеб. для хим. и биол. спец. пед. ун-тов и ин-тов / Ю. Б. Филиппович. — 4-е изд., перераб. и доп. — М.: «Агар», 1999. — 512 с., ил.
- Березов, Т. Т. Биологическая химия: Учебник / Т. Т. Березов, Б. Ф. Коровкин. — 3-е изд., перераб. и доп. — М.: Медицина, 1998. — 704 с., ил.
- Овчинников, Ю. А. Биоорганическая химия / Ю. А. Овчинников. — М.: Просвещение, 1987. — 815 с., ил.
- Племенков, В. В. Введение в химию природных соединений / В. В. Племенков. — Казань: КГУ, 2001. — 376 с.
Источник

 | Коферменты (коэнзимы) — органические соединения небелковой природы, необходимые для осуществления каталитического действия многих ферментов. Многие коферменты легко отделяются от ферментного белка и служат переносчиками электронов, отдельных атомов или групп атомов субстрата, превращение которого катализирует данный фермент, т.е. функционируют в качестве промежуточных акцепторов. АТФ, АДФ, АП5А и АМФ, НАД, НАДФ, НАД-Н, НАДФ-Н, ФАД, Коэнзим А, N-Ацетил-L-Цистеин. |
Наиболее распространенную группу составляют соединения нуклеотидной природы, а также коферменты, содержащие остатки фосфорной кислоты. Адениловые нуклеотиды — аденозин-5-трифосфат (АТФ), аденозин-5-дифосфат (АДФ), Р1,Р5
–ди(аденозин -5-) пентафосфат (АП5А) и аденозин-5-монофосфорной кислоты (АМФ) наряду с их ключевой ролью в обмене энергии участвуют в реакциях переноса и активации орто- и пирофосфатных остатков, аминоацильных групп, остатков неорганических кислот.
 | К важнейшим коферментам нуклеотидной природы относятся никотинамидные коферменты — никотинамид-β-аденин динуклеотид (НАД) и его фосфорилированное производное никотинамид-β-аденин динуклеотид фосфат (НАДФ). Они входят в состав ряда дегидрогеназ — катализаторов ключевых окислительно-восстановительных реакций энергетического и пластического обмена. Восстановленные формы НАД (НАД-Н) и НАДФ (НАДФ-Н) выступают в роли доноров электронов и протона. Считается, что НАД и НАДФ имеют разные функции. НАД участвует в катаболических процессах как окислитель, а восстановленная форма НАДФ (НАДФ-Н) — в анаболических процессах в качестве восстановителя. |
 | Другим важным переносчиком электронов в окислительных реакциях в клетке является флавинаденин динуклеотид (ФАД), принимающие участие в обмене основных классов органических соединений и играющих важную роль в процессе биологического окисления. Коэнзим А — играет роль в переносе и активировании кислотных остатков в реакциях ацилирования, конденсации, оксидоредукции или гидратации органических кислот. Коэнзим А участвует в реакциях окисления, синтеза жирных кислот, липидов. |
N-Ацетил-L-Цистеин — это модифицированная форма цистеина, которая была присоединена к ацетил группе. Было доказано, что N-Ацетил-L-Цистеин способен увеличивать уровень антиоксиданта глутатиона. Свойства N-Ацетил-L-Цистеин главным образом связаны с его тиоловой группой, которая делает его эффективным в большинстве биохимических путей, где задействован трипептидглутатион. Цистеин находится среди трех аминокислот, содержащих трипептидглутатион, так что N-Ацетил-L-Цистеин считается предшественником трипептидглутатиона с его деацетилированным цистеином. Ацетил-L-Цистеин использовался и по-прежнему широко используется в качестве муколитического агента, когда способ действия в целом относится к окислительно-восстановительному разрушению чувствительных дисульфидных мостиков цистеина в белках слизи.
Цена
в валюте производителя /
в рублях
1968.0500 | 500 г | 35 155,= 435,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
1968.0100 | 100 г | 7 386,= 91,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
1968.0025 | 25 г | 1 939,= 24,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
1943.0050 | 50 мг | 9 621,= 119,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
1943.0010 | 10 мг | 2 021,= 25,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
1942.0500 | 500 мг | 23 513,= 291,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
1942.0100 | 100 мг | 5 016,= 62,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
1942.0025 | 25 мг | 1 294,= 16,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
1941.0005 | 5 г | 520,= 6,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
1940.0100 | 100 г | 24 757,= 306,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
1940.0025 | 25 г | 6 189,= 77,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
1939.0005 | 5 г | 3 837,= 47,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
1939.0001 | 1 г | 825,= 10,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
1938.0001 | 1 г | 718,= 9,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
1937.0001 | 1 г | 759,= 9,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
1937.0100 | 100 мг | 165,= 2,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
1936.0001 | 1 г | 3 317,= 41,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
1936.0250 | 250 мг | транспортировка -8…+2°C | 875,= 11,= EUR | |||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
3371.0001 | 1 г | 1 981,= 24,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
1934.0100 | 100 мг | хранение +2…+8°C, транспортировка -8…+2°C | 3 656,= 45,= EUR | |||||||||||||||||||||||||||||||||||||||||||||
1934.0001 | 1 г | 34 825,= 430,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
A-1622,0010ДУ | Стандартная цена: 74,= EUR. Стандартная цена: 6 024,=. | 10 г | СПЕЦЦЕНА 3 012,= 37,= EUR | |||||||||||||||||||||||||||||||||||||||||||||
CAS-No. 4578-31-8 | ||||||||||||||||||||||||||||||||||||||||||||||||
A-1124,0100 | 100 г | |||||||||||||||||||||||||||||||||||||||||||||||
CAS-No. 53-84-9 | ||||||||||||||||||||||||||||||||||||||||||||||||
A-0948,0001исг | Стандартная цена: 40,= EUR. Стандартная цена: 3 235,=. | 1 г | СПЕЦЦЕНА 2 265,= 28,= EUR | |||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
A5285-1GДУ | 1 г | |||||||||||||||||||||||||||||||||||||||||||||||
CAS-No. 72696-48-1 | ||||||||||||||||||||||||||||||||||||||||||||||||
A-1394,0250 | 250 мг | 6 688,= 83,= EUR | ||||||||||||||||||||||||||||||||||||||||||||||
CAS-No. 1184-16-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
Источник
