Какой витамин участвует в синтезе и метаболизме аминокислот
1. Участвует в образовании НАД и НАДФ.
2. Компонент дыхательной цепи.
КОФЕРМЕНТ различных дегидрогеназ.
Суточная потребность в витамине РР 20 — 25мг.
Источниками витамина РР являются дрожжи, говяжья печень, рыба, грибы, мука пшеничная, соя, бобы, хлеб, картофель, мясо. Может синтезироваться в организме при поступлении с пищей белков и витамина В6.
Гиповитаминоз проявляется в виде пеллагры:
1.Дерматит с повреждением симметричных участков кожи, повреждённых УФО.
2. Диарея.
3. Деменция.
Причины гиповитаминоза: белковое голодание, недостаток витамина В6.
Участвует в образовании ПФ:
-КОФЕРМЕНТАМИНОТРАНСФЕРАЗ.
-КОФЕРМЕНТДЕКАРБОКСИЛАЗ.
-Принимает участие в ДЕЗАМИНИРОВАНИИ.
-Необходим для образования витамина РР из триптофана.
-Сигма-АМИНОЛЕВУЛИНОВАЯ кислота ® гем.
Т.о. витамин В6 участвует в обмене аминокислот, следовательно, необходим для нормального обмена белков. Суточная потребность-2мг. Источники вит.В6: картофель, пшеница, рис, отруби, печень, дрожжи. Гиповитаминоз приводит к нарушению белкового обмена, что проявляется развитием анемии, дерматита, стоматита, глоссита.
Биотин, пантотеновая кислота, их роль в обмене веществ.
Биотин (Витамин Н антисеборейный). Метаболические функции витамина Н
1. Является КО-ферментом карбоксилаз ПВК, ацетил -КОА, пропионил-КОА.
ПВК + CО2 (вит.Н) ® ЩУК
2. Участвует в реакциях синтеза жирных кислот и стерина.
Суточная потребность в витамине Н 0,15 — 0,2мг. Источниками витамина Н являются: печень, соя, молоко, яйца, мука, лук, морковь, апельсины, дрожжи, арахис. Синтезируется микрофлорой кишечника. Гиповитаминоз проявляется в виде чешуйчатого дерматита (носогубной треугольник и волосистая часть головы), конъюктивита, анемии, себореи. Причины гиповитаминоза: дисбактериозы., заболевания ПЖЖ, в которой синтезируется фермент БИОТИНИДАЗА, освобождающий биотин от белка; если этого фермента нет, то БИОТИН не усваивается.
ПАНТОТЕИНОВАЯ КИСЛОТа (витамин ВЗ или В5).
Является производной бета -АЛАНИНА, соединенной с производным масляной кислоты. Метаболические функции ПАНТОТЕИНОВОЙ кислоты.
1. Входит в состав КО-фермента А, следовательно, участвует в синтезе АЦЕТИЛ-КОА,
различных АЦИЛ-КОА, образующихся в результате следующих реакций:
-ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ альфа –КЕТОКИСЛОТ.
— Синтез и окисление жирных кислот, синтез СТЕРОИДОВ.
2. Участвует в синтезе более 80 различных ферментов.
Суточная потребность 10-15мг. Источники: печень, дрожжи, пчелиное молочко. Синтезируется микрофлорой кишечника. Гиповитаминоз характеризуется поражением -малых -артерий нижних конечностей.
53. Сигнальные молекулы и химические частицы, их классификация. Виды регуляторных эффектов сигнальных молекул. Факторы роста. Отличительные признаки гормонов. Классификация гормонов. Понятие о клетке мишени. Роль гипоталамуса в гормональной регуляции. Виды регуляции обмена веществ. Внешняя регуляция .
Сигнальные молекулы являются лигандами для рецепторов клеток-мишеней. Характерные особенности сигнальных молекул.
1.малый период жизни (динамичность, оперативность регуляции).
2.высокая биологическая активность (действие развивается при очень низких концентрациях).
3.уникальность, неповторимость действия.
4.наличие эффекта усиления (одна сигнальная молекула может усиливать каскады биохимических реакций).
5.один вид сигнальных молекул может иметь несколько клеток-мишеней.
6.реакция разных клеток-мишеней на одну и ту же сигнальную молекулу отличается.
Регуляция метаболизма: внутренняя и внешняя. Внутренняя регуляция — управляющие сигналы образуются и действуют внутри одной и той же клетки (само-регуляция). Внешняя регуляция — управляющие сигналы поступают к клетке из внешней среды. Внутренняя регуляция осуществляется путём изменения активности ферментов активаторами или ингибиторами. Внешняя регуляция обеспечивается специализированными сигнальными молекулами, которые в результате взаимодействия с ферментами обеспечивают внешнее управление биохимическими процессами в клетках-мишенях.
Клетка-мишень — это клетка, имеющая специализированные воспринимающие рецепторы для данного вида сигнальных молекул.
Виды регуляторных эффектов сигнальных молекул:
1.Эндокринный. Сигнальные молекулы поступают с током крови из желудочно-воротной системы к клеткам-мишеням. 2.Паракринный — сигнальные молекулы вырабатывают в пределах одного органа или участка ткани.
3.Аутокринное — сигнальные молекулы действуют на клетку, их образовавшую.
КЛАССИФИКАЦИЯ СИГНАЛЬНЫХ МОЛЕКУЛ.
1)По химической природе:
- 1.Органические (производные аминокислот, жиров). СТЕРОИДЫ, ПРОСТОГЛАНДИНЫ.
- 2.Неорганические — 1992г. МОНООКСИДАЗОТА (NO).
2)По физико-химическим свойствам:
1.Липофобные — не могут проникать через мембрану клетки. Они растворимы в воде.
2.Липофильные — растворяются в жирах. Свободно проникают через ЦПМ и действуют на рецепторы внутри клетки.
3)По биологическому принципу:
1.Гормоны — сигнальные молекулы с выраженным эндокринным эффектом.
2.Цитокины — факторы роста. Это сигнальные молекулы белковой природы, которые выделяются неспециализированными клетками организма. Они регулируют рост, дифференцировку, пролиферацию соседних клеток. Действие пара- и аутокринно.
3.Нейромедиаторы сигнальные молекулы, вырабатывающиеся нервными клетками, координирующие работу нейронов и управление периферическими тканями. Их действие связано с влиянием на ионные каналы. Они изменяют их проницаемость и вызывают деполяризацию мембраны. ГИПОТАЛАМУС является компонентом и своеобразным «выходным каналом» лимбической системы. Это отдел промежуточного мозга, контролирующий различные параметры гомеостаза. С одной стороны он связан с ЦНС (центры ВНС), с другой — с гипофизом через нервные проводники и особую портальную систему.
ГИПОТАЛАМУС участвует во многих функциях нервной регуляции, выделяя НЕЙРОТРАНСМИТТЕРЫ и. а также регулирует эндокринную систему.
Вторые посредники в действии липофобных сигнальных молекул, цАМФ и цГМФ -зависимые механизмы действия. Аденилатциклаза, протеинкиназа. Продемонстрировать эффекты гормонов, осуществляющие регуляторное действие при участии цАМФ.
МЕХАНИЗМ ДЕЙСТВИЯ, ЗАВИСИМЫЙ ОТ ЦАМФ.
Факторы, необходимые для этого:
o растворимая в воде сигнальная молекула;
o поверхностные рецепторы клетки-мишени;
o внутриклеточный трансдуктор G-белок. Состоит из 3 единиц: альфа, бета, гамма.
· G-белок может быть ингибирующий и активирующий. G-белок способен присоединять ГДФ или ГТФ.
o АДЕНИЛАТЦИКЛАЗА(АЦ) (превращает АТФ в ЦАМФ);
· ПРОТЕИНКИНАЗА-А ЦАМФ-зависимая. Она катализирует реакцию фосфорилирования белков;
o Регуляторные элементы ДНК (ЭЕХАНСЕР и САЙЛЕНСЕР);
o ФОСФОДИЭСТЕРАЗА — разрушает ЦАМФ;
o ФОСФАТАЗА — дефосфорилируют белки;
o Белок-синтетический аппарат клетки.
Этапы, стимулирующие ЦАМФ -зависимый механизм:
1. взаимодействие сигнальной молекулы с рецептором;
2. изменение конформации G-белка;
3. замена ГДФ на ГТФ в альфа-S единице G-белка;
4. альфа-S ГТФ активирует АЦ;
5. АЦ синтезирует ЦАМФ;
6. ЦАМФ активирует ПРОТЕИНКИНАЗУ-А (ПКА);
7. ПКА фосфорилирует белки и белковые факторы транскрипции, изменяющие активность и количество ферментов;
8. Прекращение действия.
— ФОСФОДИЭСТЕРАЗА — разрушает ЦАМФ.
— ФОСФАТАЗА — ДЕФОСФОРИЛИРУЕТ белки.
Этапы, ингибирующие ЦАМФ -зависимый механизм:
С первого по третий те же самые этапы, отличие в G-белке (альфа-I единица). Четвёртый этап — связывание ГТФ с альфа-I единицей будет ингибировать АЦ. Ингибируюший механизм противодействует и прекращает эффекты ЦАМФ в клетке. ЦГМФ -зависимый стимулирующий механизм действия.
Рецептор встроен в мембрану клетки и связан с ферментом ГУАНИЛАТЦИКЛАЗОЙ (ГЦ). При присоединении сигнальной молекулы ГЦ активируется и катализирует реакцию ГТФ * ЦГМФ. Последний активирует ПРОТЕИНКИНАЗУ-G (ПКО), а она запускает реакцию фосфорилирования белков (ферментов и факторов транскрипции).
Альдостерон — регуляция объема внутриклеточной жидкости, повышение реабсорбции воды и натрия. Тироксин – повышение основного обмена
Механизм действия липофильных сигнальных молекул. Механизм действия NО. Действие сигнальных молекул через тирозинкиназные рецепторы. Принципы иммунноферментного анализа уровня сигнальных молекул.
1.взаимодействие с внутриклеточными рецепторами,
2.регуляторный эффект связан с изменением количества белков в результате влияния на экспрессию генов
3. биологическое действие продолжительное, но развивается медленно в пределах часов.
Факторы, необходимые для их действия:
— сигнальные молекулы,
— воспринимающий внутриклеточный рецептор, связанный с шапероном.
— участок ДНК, регулирующий транскрипцию определённых генов (ЭНХАНСЕР, САЙЛЕНСЕР),
— белок синтетический аппарат клетки.
Этапы действия:
1. проникновение внутрь клетки,
2. связывание с внутриклеточным рецептором,
3. освобождение шаперона (запуск таймера действия),
4. взаимодействие комплекса сигнальных молекул с регуляторными элементами ДНК, изменение биосинтеза некоторых белков, в том числе и их ферментов.
5. изменение метаболизма и клеточных функций.
Механизм прекращения действия органических липофильных сигнальных молекул:
o разрушение рецепторов, обусловленное отсутствие защиты со стороны шаперона,
o протеолиз синтезированных белков,
o разрушение факторов транскрипции, участвующих в передаче сигналов к структурному гену.
По перечисленному механизму действуют СТЕРОИДНЫЕ гормоны и ЙОДТИРОНИН.
ТИРОЗИНКИНАЗА — фермент, фосфорилирующий белки. По этому механизму действует большинство факторов роста и пролиферации. Наблюдается отсутствие МЕССЕНДЖЕРОВ. Рецептор оказывает влияние на ферментные системы клетки. Он может поступать в ядро вместе с сигнальными молекулами и усиливать транскрипцию генов и изменять митотическую активность клетки.
Механизм действия НЕОРГАНИЧЕСКИХ ЛИПОФОБНЫХ сигнальных молекул (NO). NO беспрепятственно проникает через мембрану клетки. Образуется из аргинина. В клетке NO взаимодействует с ГЦ, активирует её, что вызывает накопление в клетке ЦГМФ. который активирует ПКО, и развивается клеточный ответ по выше рассмотренному механизму.
Эффекты NO:
1. фактор расширения сосудов;
2. регулятор АПОПТОЗА (запрограммированной клеточной смерти);
3.NO является свободным радикалом, поэтому способен влиять на ПОЛ и регулировать функции МИТОХОНДРИЙ;
4. является ИММУНОМОДУЛЯТОРОМ.
Источник
Источники
Растительные продукты, дрожжи, мясо, печень, почки, желток яиц. Витамин активно синтезируется дружественной кишечной микрофлорой.
Суточная потребность
400 мкг.
Строение
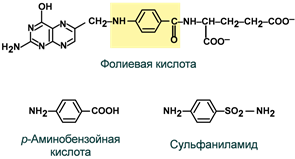
Витамин представляет собой комплекс из трех составляющих – птеридина, пара-аминобензойной кислоты и глутаминовой кислоты. Остатков глутамата, соединенных через γ-карбоксильную группу, может быть разное количество.
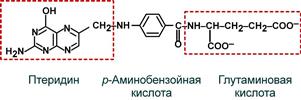
Строение фолиевой кислоты
Коферментной формой витамина является тетрагидрофолиевая кислота (ТГФК, Н4-ФК).
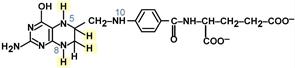
Строение тетрагидрофолиевой кислоты
Биохимические функции
Непосредственная функция тетрагидрофолиевой кислоты – перенос одноуглеродных фрагментов, которые присоединяются к атомам N5 или N10:
- формила – в составе N5-формил-ТГФК и N10-формил-ТГФК,
- метенила – в качестве N5,N10-метенил-ТГФК,
- метилена – в виде N5,N10-метилен-ТГФК,
- метила – в форме N5-метил-ТГФК,
- формимина – в составе N5-формимино-ТГФК.
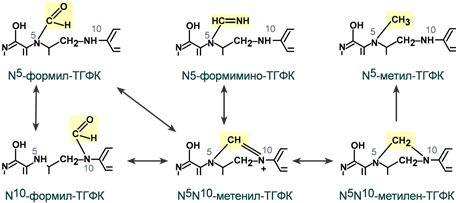
Строение и взаимопревращение активных форм
тетрагидрофолиевой кислоты
(часть структуры ТГФК не показана)
Благодаря способности переносить одноуглеродные фрагменты, витамин:
- в виде N10-формил-ТГФК и N5,N10-метенил-ТГФК участвует в синтезе пуриновых нуклеотидов,
- в виде N5,N10-метилен-ТГФК участвует в образовании тимидинмонофосфата, и, следовательно, в синтезе ДНК,
- участвует в обмене аминокислот – обратимое превращение глицина и серина,
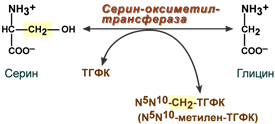
Пример реакции с участием фолиевой кислоты
- N5-метил-ТГФК взаимодействует с витамином В12, являясь донором метильной группы при превращении гомоцистеина в метионин.
В клетке N5-метил-ТГФК образуется в необратимой реакции из N5,N10-метилен-ТГФК. При этом единственным способом получить свободную ТГФК для других клеточных нужд является реакция превращения гомоцистеина в метионин. При дефиците витамина В12 эта реакция нарушается и возникает внутриклеточный дефицит витамина B9, хотя и в клетке и в крови его (в виде метил-ТГФК) может быть много. Такое явление получило название «ловушка для фолата».
Гиповитаминоз B9
Причина
Пищевая недостаточность, кислые продукты, тепловая обработка пищи, прием лекарств (барбитураты, сульфаниламиды и антибиотики, некоторые цитостатики – аминоптерин, метотрексат), алкоголизм и беременность.
Клиническая картина
Дефицит фолиевой кислоты в организме тормозит синтез тимидилтрифосфата, что приводит к снижению синтеза ДНК в быстроделящихся клетках – костного мозга, эпителиальных тканей.
В первую очередь затрагиваются органы кроветворения: так как клетки не теряют способности расти, но в них происходит нарушение синтеза ДНК с остановкой деления, то это приводит к образованию мегалобластов (крупных незрелых клеток) и мегалобластической анемии. По той же причине наблюдается лейкопения.
Аналогично развивается поражение слизистых желудка и кишечного тракта (гастриты, энтериты), глоссит. Отмечается замедление роста, конъюнктивит, ухудшение заживления ран, иммунодефициты, оживление хронических инфекций и субфебрилитет.
Лекарственные формы
Фолинат кальция.
Антивитамины
Антивитамином В9 является группа лекарственных антибактериальных соединений сульфаниламидов структурно схожих с компонентом фолиевой кислоты — парааминобензойной кислотой (ПАБК). В бактериальной клетке происходит конкуренция за активный центр фермента и нарушается использование ПАБК для синтеза фолиевой кислоты, что ведет к прекращению синтеза тимидилового нуклеотида, подавлению синтеза ДНК и размножения бактерии.

Сходство строения сульфаниламидов
и парааминобензойной кислоты
Источник
Биоти́н
(витамин Н, витамин B7, кофермент R) —
водорастворимый витамин группы В.
Молекула биотина состоит из
тетрагидроимидазольного и
тетрагидротиофенового кольца, в
тетрагидротиофеновом кольце один из
атомов водорода замещен на валериановую
кислоту. Биотин является кофактором в
метаболизме жирных кислот, лейцина и в
процессе глюконеогенеза.
Входит
в состав ферментов, регулирующих белковый
и жировой обмен, обладает высокой
активностью. Участвует в синтезе
глюкокиназы — фермента, регулирующего
обмен сахаров.
Является
коферментом различных ферментов, в том
числе и транскарбоксилаз. Участвует в
синтезе пуриновых нуклеотидов. Является
источником серы, которая принимает
участие в синтезе коллагена. С участием
биотина протекают реакции активирования
и переноса СО2.
По
последним данным, биотин играет важную
роль в углеводном обмене, взаимодействуя
с гормоном поджелудочной железы
инсулином. Кроме того, биотин участвует
в производстве так называемой глюкокиназы
— вещества, которое «запускает»
обмен глюкозы.
Глюкокиназа
вырабатывается в печени, там же, где
хранится биотин. Это особенно важно для
диабетиков, у которых содержание
глюкокиназы в печени понижено. Немалую
роль играет биотин и в синтезе гликогенов
— накапливаемых в печени и мышцах
углеводов, а также в усвоении этих
запасов и в так называемом глюконеогенезе,
в процессе которого 16 из 22 аминокислот
преобразуются в глюкозу. Этот процесс
исключительно важен для поддержания
стабильного уровня сахара в крови. Таким
образом биотин стабилизирует содержание
сахара в крови.
Он
помогает также усваивать белок и в
обмене веществ является важным союзником
других витаминов группы В, таких как
фолиевая и пантотеновая кислоты и
витамин В12. Кроме того, он участвует в
разложении жирных кислот и в сжигании
жира.
Биотин
зарекомендовал себя как идеальное
транспортное средство, которое всегда
доставляет свой груз серы строго по
назначению.
Поскольку
биотин контролирует обмен жиров и
преимущественно находится в клетках
кожи и волос, он, естественно, влияет на
содержание жира в коже.
Поскольку
биотин оптимизирует использование
жирных кислот в организме и делает кожу
головы менее маслянистой, он может
улучшать общую структуру и внешний вид
волос.
Еще
одна важная задача биотина заключается
в том, чтобы связывать двуокись углерода
с пуринами, в которых содержится
наследственная информация нашего
организма. Он требуется и для синтеза
гемоглобина — пигмента красных кровяных
телец.
17. Биохимическая функция витамина в12
Витаминами
B12 называют группу кобальтсодержащих
биологически активных веществ, называемых
кобаламинами. К ним относят собственно
цианокобаламин — продукт, получаемый
при химической очистке витамина
цианидами, гидроксикобаламин и две
коферментные формы витамина B12:
метилкобаламин и 5-дезоксиаденозилкобаламин.
В
более узком смысле витамином B12 называют
цианокобаламин, так как именно в этой
форме в организм человека поступает
основное количество витамина B12, не
упуская из вида то, что он не синоним с
B12 и несколько других соединений также
обладают B12 витаминной активностью.
Цианокобаламин лишь один из них.
Следовательно, цианокобаламин всегда
витамин B12, но не всегда витамин B12
является цианокобаламином.
Ковалентная
связь C-Co кофермента B12 участвует в двух
типах ферментативных реакций:
-Реакции
переноса атомов, при которых атом
водорода переносится непосредственно
с одной группы на другую, при этом
замещение происходит по алкильной
группе, спиртовому атому кислорода или
аминогруппе.
-Реакции
переноса метильной группы (-CH3) между
двумя молекулами.
В
организме человека есть только два
фермента с коферментом B12:
Метилмалонил-КоА-мутаза,
фермент, использующий в качестве
кофактора аденозилкобаламин и при
помощи реакции, упомянутой выше в п.1,
катализирует перестановку атомов в
углеродном скелете. В результате реакции
из L-метилмалонил-КоА получается
сукцинил-КоА. Эта реакция является
важным звеном в цепи реакций биологического
окисления белков и жиров.
5-метилтетрагидрофолат-гомоцистеин-метилтрансфераза,
фермент из группы метилтрансфераз,
использующий в качестве кофактора
метилкобаламин и при помощи реакции,
упомянутой выше в п.2, катализирует
превращение аминокислоты гомоцистеина
в аминокислоту метионин.
Соседние файлы в папке Всякое
- #
- #
- #
- #
- #
- #
- #
- #
Источник
