Какие витамины входят в состав оксидоредуктаз
Àâòîð òåêñòà Àíèñèìîâà Åëåíà Ñåðãååâíà.
Àâòîðñêèå ïðàâà çàùèùåíû. Ïðîäàâàòü òåêñò íåëüçÿ.
Êóðñèâ íå çóáðèòü.
Çàìå÷àíèÿ ìîæíî ïðèñûëàòü ïî ïî÷òå: exam_bch@mail.ru
https://vk.com/bch_5
Ïàðàãðàô ó÷åáíèêà ïî áèîõèìèè 20.2
«Âèäû îêñèäîðåäóêòàç».
ñì. ï.3.
Ñì. òàáëèöó â ôàéëå «20.2 Òàáëèöà îêñèäîðåäóêòàçû».
Îïðåäåëåíèå.
Îêñèäîðåäóêòàçû ýòî êëàññ ôåðìåíòîâ, êîòîðûå êàòàëèçèðóþò îêèñëèòåëüíî-âîññòàíîâèòåëüíûå ðåàêöèè.
Îñíîâíûå ãðóïïû (íå òîëüêî ïîäêëàññû) îêñèäîðåäóêòàç:
äåãèäðîãåíàçû, îêñèäàçû, îêñèãåíàçû,
ðåäóêòàçû, öèòîõðîìû è àíòèîêèñëèòåëüíûå ôåðìåíòû.
×òî òàêîå îêèñëåíèå è âîññòàíîâëåíèå.
Îêèñëåíèå ýòî îòùåïëåíèå ýëåêòðîíà,
à âîññòàíîâëåíèå ýòî ïðèñîåäèíåíèå ýëåêòðîíà.
Îêèñëåíèå è âîññòàíîâëåíèÿ âñåãäà ñîïðÿæåíû, òî åñòü ñâÿçàíû,
ïîòîìó ÷òî åñëè îäíî âåùåñòâî òåðÿåò ýëåêòðîí
è ïðè ýòîì îêèñëÿåòñÿ,
òî äðóãîå âåùåñòâî ýòîò ýëåêòðîí ïðèîáðåòàåò
è ïðè ýòîì âîññòàíàâëèâàåòñÿ.
Ïðè âîññòàíîâëåíèè îðãàíè÷åñêèõ ñóáñòðàòîâ
ýëåêòðîíû ÷àñòî ïðèñîåäèíÿþòñÿ â ñîñòàâå àòîìîâ âîäîðîäà
(êàæäûé èç êîòîðûõ ñîñòîèò èç îäíîãî ýëåêòðîíà è îäíîãî ïðîòîíà),
èñòî÷íèêîì êîòîðûõ ÿâëÿåòñÿ ÍÀÄÔÍ,
êîòîðûé ïîëó÷àåò àòîìû âîäîðîäà â ÏÔÏ (ï.35).
Ïðè îêèñëåíèè îðãàíè÷åñêèõ ñóáñòðàòîâ
ýëåêòðîíû îòùåïëÿþòñÿ îáû÷íî â ñîñòàâå àòîìîâ âîäîðîäà,
êîòîðûå ïåðåíîñÿòñÿ íà êîôåðìåíò (ÍÀÄ è äð.) èëè êèñëîðîä.
Ïðèñîåäèíåíèå àòîìîâ êèñëîðîäà
òîæå ÿâëÿåòñÿ îêèñëåíèåì îðãàíè÷åñêîãî ñóáñòðàòà,
ïîñêîëüêó ïðèñîåäèíèâøèåñÿ àòîìû êèñëîðîäà ïðèòÿãèâàþò ê ñåáå ýëåêòðîííóþ ïëîòíîñòü òåõ àòîìîâ, â êîòîðûì îíè ïðèñîåäèíèëèñü.
1. Ä Å Ã È Ä Ð Î Ã Å Í À Ç Û
êàòàëèçèðóþò ðåàêöèè äåãèäðèðîâàíèÿ,
òî åñòü îòùåïëåíèÿ àòîìîâ âîäîðîäà (Í).
Ïðè ýòîì âîäîðîä
(2 àòîìà âîäîðîäà, ñîñòîÿùèå èç 2 ïðîòîíîâ è 2 ýëåêòðîíîâ)
îòùåïëÿåòñÿ îò îðãàíè÷åñêîãî ñóáñòðàòà (R)
è ïåðåíîñèòñÿ íà êîôåðìåíò (íà ÊîÔ ÍÀÄ+, ÔÀÄ èëè ÍÀÄÔ+).
Ôîðìóëèðóÿ êîðî÷å äåãèäðîãåíàçû ïåðåíîñÿò 2 àòîìà âîäîðîäà
îò ñóáñòðàòà íà êîôåðìåíò.
Ñóáñòðàò äî îòùåïëåíèÿ îò íåãî ïàðû àòîìîâ âîäîðîäà
íàçûâàåòñÿ âîññòàíîâëåííûì ñóáñòðàòîì
è îáîçíà÷àåòñÿ òàê RÍ2;
ãäå Í ýòî àòîìû âîäîðîäà, êîòîðûå áóäóò îòùåïëÿòüñÿ,
à R ýòî îñòàëüíûå àòîìû ìîëåêóëû ñóáñòðàòà.
Ñóáñòðàò ïîñëå îòùåïëåíèÿ îò íåãî ïàðû àòîìîâ âîäîðîäà
îáîçíà÷àåòñÿ òàê R
è íàçûâàåòñÿ îêèñëåííûì.
Êîôåðìåíò, ïîëó÷àþùèé àòîìû âîäîðîäà,
äî èõ ïðèñîåäèíåíèÿ îáîçíà÷àåòñÿ êàê ÊîÔ,
à ïîñëå ïðèñîåäèíåíèÿ äâóõ Í îáîçíà÷àåòñÿ êàê ÊîÔÍ2.
Ïîñêîëüêó ïðè îòùåïëåíèè àòîìîâ âîäîðîäà
âåùåñòâî òåðÿåò âìåñòå ñ âîäîðîäîì
âõîäÿùèå â ñîñòàâ âîäîðîäà ýëåêòðîíû,
à ïîòåðÿ ýëåêòðîíîâ íàçûâàåòñÿ îêèñëåíèåì,
òî RÍ2 áîëåå âîññòàíîâëåííîå âåùåñòâî, ÷åì R,
à ÊîÔÍ2 áîëåå âîññòàíîâëåííîå âåùåñòâî, ÷åì ÊîÔ.
Ïîýòîìó RÍ2 íàçûâàþò âîññòàíîâëåííûì ñóáñòðàòîì,
à R îêèñëåííûì ñóáñòðàòîì.
ÊîÔ2 íàçûâàþò âîññòàíîâëåííûì êîôåðìåíòîì
(âîññòàíîâëåííîé ôîðìîé êîôåðìåíòà),
à ÊîÔ îêèñëåííûì êîôåðìåíòîì
(îêèñëåííîé ôîðìîé êîôåðìåíòà).
Ñõåìà ðåàêöèè, êîòîðàÿ êàòàëèçèðóåòñÿ äåãèäðîãåíàçàìè,
ìîæåò áûòü ïðåäñòàâëåíà â òàêîì âèäå:
RH2 + ÊîÔ ; R + ÊîÔÍ2.
Ãäå RH2 ýòî âîññòàíîâëåííûé ñóáñòðàò
(îðãàíè÷åñêèé ñóáñòðàò äî îòùåïëåíèÿ âîäîðîäà),
ÊîÔ îêèñëåííûé êîôåðìåíò
(êîôåðìåíò äî ïðèñîåäèíåíèÿ ê íåìó îòùåïëåííîãî îò ñóáñòðàòà âîäîðîäà),
R îêèñëåííûé ñóáñòðàò
(îðãàíè÷åñêèé ñóáñòðàò ïîñëå îòùåïëåíèÿ îò íåãî âîäîðîäà),
ÊîÔÍ2 âîññòàíîâëåííûé êîôåðìåíò
(êîôåðìåíò ïîñëå ïðèñîåäèíåíèÿ ê íåìó îòùåïëåííîãî îò ñóáñòðàòà âîäîðîäà).
Êîôåðìåíòû, êîòîðûå ó÷àñòâóþò â ðàáîòå äåãèäðîãåíàç:
ÍÀÄ+, ÔÀÄ è ÍÀÄÔ+.
ÍÀÄ+, ÔÀÄ è ÍÀÄÔ+ ýòî îáîçíà÷åíèÿ îêèñëåííûõ ôîðì êîôåðìåíòîâ,
à ÍÀÄÍ,Í+, ÔÀÄÍ2 è ÍÀÄÔÍ,Í+ ýòî îáîçíà÷åíèÿ âîññòàíîâëåííûõ ôîðì êîôåðìåíòîâ.
ÍÀÄÍ, Í+ è ÔÀÄÍ2 ïåðåíîñÿò âîäîðîä
îò ñóáñòðàòîâ â ÄÖ (äëÿ âûðàáîòêè ÀÒÔ),
à ÍÀÄÔÍ, Í+ ïåðåíîñèò âîäîðîä îò ìåòàáîëèòîâ ÏÔÏ íå â ÄÖ,
à â ðåàêöèè,
êàòàëèçèðóåìûå ðåäóêòàçàìè è ãèäðîêñèëàçàìè.
Äåãèäðîãåíàçû êàòàëèçèðóþò ðåàêöèè
ïðîöåññîâ îêèñëèòåëüíîãî êàòàáîëèçìà.
Ñì. ï.32, 45, 65.
2. Î Ê Ñ È Ä À Ç Û
êàòàëèçèðóþò äåãèäðèðîâàíèå,
ïðè êîòîðîì âîäîðîä, îòùåïëåííûé îò ñóáñòðàòà, ïðèñîåäèíÿåòñÿ ê êèñëîðîäó (Î2).
Ôîðìóëèðóÿ êîðî÷å äåãèäðîãåíàçû ïåðåíîñÿò 2 àòîìà âîäîðîäà
îò ñóáñòðàòà íà êèñëîðîä.
Ñõåìà ðåàêöèè, êîòîðàÿ êàòàëèçèðóåòñÿ îêñèäàçàìè,
ìîæåò áûòü ïðåäñòàâëåíà â òàêîì âèäå:
RH2 + Î2 ; R + Í2Î2.
Ãäå RH2 ýòî âîññòàíîâëåííûé ñóáñòðàò,
R îêèñëåííûé ñóáñòðàò
(îðãàíè÷åñêèé ñóáñòðàò ïîñëå îòùåïëåíèÿ îò íåãî âîäîðîäà).
Êèñëîðîä â ðåçóëüòàòå ýòîé ðåàêöèè âîññòàíàâëèâàåòñÿ.
Äëÿ ðàáîòû îêñèäîðåäóêòàç íóæåí êîôåðìåíò ÔÀÄ
è âèòàìèí Â2 â ñîñòàâå ÔÀÄ.
Îñíîâíûå ïðèìåðû îêñèäàç
ýòî êñàíòèí/îêñèäàçà (ÊñÎ) â ï.71
è ìîíîàìèí/îêñèäàçà (ÌÀÎ) â ï.105.
ÊñÎ ó÷àñòâóåò â êàòàáîëèçìå ïóðèíîâ
(àäåíèíà è ãóàíèíà,
íî ñóáñòðàòû ÊñÎ ãèïîêñàíòèí è êñàíòèí;
ïîä äåéñòâèåì ÊñÎ ãèïîêñàíòèí ïðåâðàùàåòñÿ â êñàíòèí,
à êñàíòèí â ìî÷åâóþ êèñëîòó).
ÌÀÎ ó÷àñòâóåò â îêèñëåíèè àìèíîâ (àäðåíàëèíà, íàïðèìåð).
Èíãèáèòîðû ÊñÎ ïðèìåíÿþòñÿ äëÿ ñíèæåíèÿ âûðàáîòêè óðàòîâ (ñì. ãèïåð/óðèêåìèè),
à èíãèáèòîðû ÌÀÎ ïðèìåíÿþòñÿ â êà÷åñòâå àíòèäåïðåññàíòîâ.
Îêñèäàçû ó÷àñòâóþò â ðåàêöèÿõ ñâîáîäíîãî îêèñëåíèÿ ï.26.
Ñõîäñòâî è îòëè÷èÿ äåãèäðîãåíàç è îêñèäàç:
ñõîäñòâî â òîì, ÷òî êàòàëèçèðóþò îòùåïëåíèå âîäîðîäà (äåãèäðèðîâàíèå),
îòëè÷èÿ â òîì, ÷òî
äåãèäðîãåíàçû ïåðåíîñÿò îòùåïë¸ííûé îò ñóáñòðàòîâ âîäîðîä íà êîôåðìåíòû,
à îêñèäàçû íà êèñëîðîä (îêñè).
3. Î Ê Ñ È Ã Å Í À Ç Û
êàòàëèçèðóþò âêëþ÷åíèå â ìîëåêóëó îðãàíè÷åñêîãî ñóáñòðàòà
àòîìîâ êèñëîðîäà, èñòî÷íèêîì êîòîðûõ ÿâëÿåòñÿ Î2.
Àòîìû êèñëîðîäà âêëþ÷àþòñÿ
ìåæäó àòîìîì âîäîðîäà îðãàíè÷åñêîãî ñóáñòðàòà
è àòîìîì óãëåðîäà ñóáñòðàòà,
ïîýòîìó ìîëåêóëà îðãàíè÷åñêîãî ñóáñòðàòà
äî âêëþ÷åíèÿ â íåå àòîìîâ êèñëîðîäà îêñèãåíàçàìè îáîçíà÷àåòñÿ òàê RÍ,
à ïîñëå âêëþ÷åíèÿ àòîìîâ êèñëîðîäà
ëèáî R-Î-Î-Í (åñëè âêëþ÷åíû îáà àòîìà Î2),
ëèáî R-Î-Í (åñëè âêëþ÷åí îäèí àòîì Î2).
Äèîêñèãåíàçû
3.1). Îêñèãåíàçû, êîòîðûå âêëþ÷àþò â ìîëåêóëó ñóáñòðàòà
îáà àòîìà êèñëîðîäà,
íàçûâàþòñÿ ÄÈîêñèãåíàçàìè;
ñõåìó ðåàêöèè ìîæíî çàïèñàòü òàê:
RH + Î2 ; R-Î-Î-Í.
Ïðîäóêò ðåàêöèè (R-Î-Î-Í)
íàçûâàåòñÿ îðãàíè÷åñêîé ïåðåêèñüþ.
RÎÎÍ áîëåå îêèñëåííîå âåùåñòâî, ÷åì RÍ,
òî åñòü îêèñëÿåòñÿ îðãàíè÷åñêèé ñóáñòðàò,
à âîññòàíàâëèâàåòñÿ êèñëîðîä.
Ìîíîîêñèãåíàçû
3.2). Îêñèãåíàçû, êîòîðûå âêëþ÷àþò â ìîëåêóëó îðãàíè÷åñêîãî ñóáñòðàòà
òîëüêî îäèí àòîì êèñëîðîäà,
íàçûâàþòñÿ ÌÎÍÎîêñèãåíàçàìè èëè ãèäðîêñèëàçàìè.
Âòîðîé àòîì êèñëîðîäà ìîëåêóëû êèñëîðîäà
ñîåäèíÿåòñÿ ñ äâóìÿ àòîìàìè âîäîðîäà, îáðàçóÿ ìîëåêóëó âîäû;
èñòî÷íèêîì àòîìîâ âîäîðîäà â ýòîì ñëó÷àå ÿâëÿåòñÿ êîôåðìåíò
ëèáî ÍÀÄÔÍ, ëèáî àñêîðáàò.
Ñõåìó ðåàêöèè ìîæíî çàïèñàòü òàê:
RH + Î2 + ÊîÔÍ2 ; R-Î-Í + ÊîÔ + Í2Î.
RÍ ýòî ñóáñòðàò, â êîòîðûé äîëæåí âêëþ÷èòüñÿ àòîì êèñëîðîäà,
R-Î-Í ýòî ñóáñòðàò ñî âêëþ÷åííûì â íåãî àòîìîì êèñëîðîäà,
Î2 ýòî èñòî÷íèê àòîìîâ êèñëîðîäà,
ÊîÔÍ2 ýòî èñòî÷íèê àòîìîâ âîäîðîäà.
Ñóáñòðàò RÍ áîëåå âîññòàíîâëåííûé ïî ñðàâíåíèþ ñ RÎÍ.
 ðåàêöèè îêèñëÿþòñÿ RÍ è ÊîÔÍ2,
à âîññòàíàâëèâàåòñÿ êèñëîðîä.
-ÎÍ ýòî ñïèðòîâàÿ (ãèäðîêñèëüíàÿ) ãðóïïà,
à RÎÍ ýòî ñïèðò.
Èç-çà òîãî, ÷òî ïðè äåéñòâèè ìîíîîêñèãåíàç
îáðàçóåòñÿ ãèäðîêñèëüíàÿ ãðóïïà,
ó íèõ åñòü ñèíîíèì ãèäðîêñèëàçû. (Íå ïóòàòü ñ ãèäðîëàçàìè.)
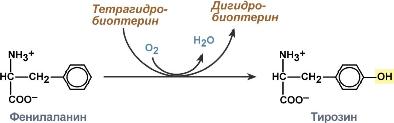
Íóæíî óìåòü íàïèñàòü ðåàêöèè,
êîòîðûå êàòàëèçèðóþò ôåíèëàëàíèí/ãèäðîêñèëàçà
è òèðîçèí/ãèäðîêñèëàçà (ï.105 è 68).
È çíàòü çíà÷åíèå ýòèõ ðåàêöèé.
Îêñèãåíàçû (êàê è îêñèãåíàçû),
ó÷àñòâóþò â ïðîöåññàõ ñâîáîäíîãî îêèñëåíèÿ.
Ó÷àñòâóþò â ìåòàáîëèçìå êñåíîáèîòèêîâ,
â îáìåíå ìíîãèõ ãîðìîíîâ,
â îáðàçîâàíèè êîëëàãåíà.
4. Ð Å Ä Ó Ê Ò À Ç Û
êàòàëèçèðóþò ïðèñîåäèíåíèå âîäîðîäà
ê îðãàíè÷åñêîìó ñóáñòðàòó,
ïðè ýòîì èñòî÷íèêîì àòîìîâ âîäîðîäà ÿâëÿåòñÿ ÍÀÄÔÍ.
Äðóãîé âàðèàíò îïðåäåëåíèÿ
ðåäóêòàçû êàòàëèçèðóþò ïåðåíîñ âîäîðîäà
îò êîôåðìåíòà íà îðãàíè÷åñêèé ñóáñòðàò.
Äåéñòâèå ðåäóêòàç ïðîòèâîïîëîæíî äåéñòâèþ äåãèäðîãåíàç.
Ïðè ïîëó÷åíèè âîäîðîäà ñóáñòðàò âîññòàíàâëèâàåòñÿ,
ïîýòîìó ðåäóêòàçû ìîæíî ñ÷èòàòü âîññòàíîâèòåëÿìè ñóáñòðàòîâ.
Ñõåìà ðåàêöèé, êîòîðûå êàòàëèçèðóþòñÿ ðåäóêòàçàìè:
R + ÊîÔÍ2 ; R + ÊîÔÍ2.
Çäåñü R îðãàíè÷åñêèé ñóáñòðàò äî ïðèñîåäèíåíèÿ âîäîðîäà,
RÍ2 îðãàíè÷åñêèé ñóáñòðàò ïîñëå ïðèñîåäèíåíèÿ ê íåìó àòîìîâ âîäîðîäà,
ÊîÔ2 âîññòàíîâëåííàÿ ôîðìà êîôåðìåíòà (èñòî÷íèê âîäîðîäà),
ÊîÔ îêèñëåííàÿ ôîðìà êîôåðìåíòà.
 ýòîé ðåàêöèè îðãàíè÷åñêèé ñóáñòðàò âîññòàíàâëèâàåòñÿ (ïðèîáðåòàåò âîäîðîä),
à êîôåðìåíò îêèñëÿåòñÿ (òåðÿåò âîäîðîä).
Ðåäóêòàçû îñíîâíûå ôåðìåíòû âîññòàíîâèòåëüíûõ ñèíòåçîâ
íàïðèìåð, ñèíòåçà æèðíûõ êèñëîò,
ñèíòåçà õîëåñòåðèíà (ÃÌÃ-ÊîÀ/ðåäóêòàçà),
ñèíòåçà äåçîêñè/ðèáîíóêëåîòèäîâ (ðèáîíóêëåîòèä/ðåäóêòàçà).
À ãëóòàòèîí/ðåäóêòàçà îòíîñèòñÿ ê àíòèîêèñëèòåëüíûì ôåðìåíòàì ï.27.
5. Ö È Ò Î Õ Ð Î Ì Û
ó÷àñòâóþò â ðåàêöèÿõ èçìåíåíèÿ âàëåíòíîñòè ìåòàëëîâ
íàïðèìåð, â ïðèñîåäèíåíèè ýëåêòðîíà ê èîíó æåëåçà Fe3+.
 ðåçóëüòàòå èîí æåëåçà Fe3+ïðåâðàùàåòñÿ â èîí æåëåçà Fe2+
(âîññòàíîâëåíèå èîíà æåëåçà).
Ñõåìà ðåàêöèè: Fe3+ + å ; Fe2+.
Ïî÷åìó (3+) ïðåâðàùàåòñÿ â (2+) ïðè ïðèñîåäèíåíèè ýëåêòðîíà ïîòîìó ÷òî ó ýëåêòðîíà îòðèöàòåëüíûé çàðÿä.
Ïîëó÷àåòñÿ (3+) + (1-) = (2+).)
 êàêèõ ïðîöåññàõ âñòðå÷àþòñÿ öèòîõðîìû
öèòîõðîìû êàòàëèçèðóþò ðÿä ðåàêöèé äûõàòåëüíîé öåïè ï.22;
íóæíî òàêæå ïîìíèòü öèòîõðîì Ð 450 ï.118.
6. À Í Ò È Î Ê È Ñ Ë È Ò Å Ë Ü Í Û Å Ô Å Ð Ì Å Í Ò Û .
Ñì. ï.27.
Ýòî ôåðìåíòû, êîòîðûå ó÷àñòâóþò â ðàçðóøåíèè àêòèâíûõ ôîðì êèñëîðîäà
è âîññòàíîâëåíèè îêèñëåííûõ èìè âåùåñòâ êëåòêè
(îðãàíè÷åñêèõ ïåðåêèñåé).
Îòíîñÿòñÿ ê àíòèîêèñëèòåëüíîé ñèñòåìå îðãàíèçìà,
ê êîòîðîé òàêæå îòíîñÿòñÿ íèçêîìîëåêóëÿðíûå àíòèîêñèäàíòû
(âèòàìèíû À, Å, Ñ è äðóãèå).
Áëàãîäàðÿ ýòîé ñèñòåìå îðãàíèçì äîëüøå ñîõðàíÿåò ìîëîäîñòü
è äîëüøå íå ïîÿâëÿþòñÿ òàêèå áîëåçíè, êàê àòåðîñêëåðîç, êàòàðàêòà è ò.ä..
Ïîäðîáíåå îá àíòèîêèñëèòåëüíûõ ôåðìåíòàõ ñêàçàíî â îòâåòå íà âîïðîñ ¹ 27.
Ïðèìåðû àíòèîêèñëèòåëüíûõ ôåðìåíòîâ
ñóïåðîêñèä/äèñìóòàçà,
ãëóòàòèîí/ïåðîêñèäàçà, ãëóòàòèîí/òðàíñôåðàçà,
ãëóòàòèîí/ðåäóêòàçà, êàòàëàçà.
Ðåàêöèè, êàòàëèçèðóåìûå îêñèäîðåäóêòàçàìè,
ìîæíî ðàçäåëèòü íà ãðóïïû
ê îäíîé ãðóïïå îòíîñÿòñÿ îêñèäîðåäóêòàçû,
êîòîðûå êàòàëèçèðóþò âîññòàíîâëåíèå îðãàíè÷åñêèõ ñóáñòðàòîâ
(ðåäóêòàçû = âîññòàíîâèòåëè),
à ê äðóãîé îêñèäîðåäóêòàçû, êîòîðûå êàòàëèçèðóþò
îêèñëåíèå îðãàíè÷åñêèõ ñóáñòðàòîâ (âñå, êðîìå ðåäóêòàç).
Îêñèäîðåäóêòàçû, êîòîðûå êàòàëèçèðóþò ðåàêöèè îêèñëåíèÿ îðãàíè÷åñêèõ ñóáñòðàòîâ,
ìîæíî ðàçäåëèòü íà òðè ãðóïïû:
1) êàòàëèçèðóþùèå îòùåïëåíèå âîäîðîäà
(äåãèäðèðîâàíèå) äåãèäðîãåíàçû è îêñèäàçû,
2) êàòàëèçèðóþùèå ïðèñîåäèíåíèå êèñëîðîäà
(îêñèãåíàöèþ) îêñèãåíàçû,
3) êàòàëèçèðóþùèå èçìåíåíèå âàëåíòíîñòè ìåòàëëîâ öèòîõðîìû.
Êàê îïðåäåëèòü, êàêàÿ ôîðìà ñóáñòðàòà áîëåå âîññòàíîâëåííàÿ,
à êàêàÿ áîëåå îêèñëåííàÿ:
÷åì áîëüøå âîäîðîäà â âåùåñòâå,
òåì áîëåå âîññòàíîâëåíî âåùåñòâî;
÷åì áîëüøå êèñëîðîäà â âåùåñòâå,
òåì áîëåå îêèñëåííîå âåùåñòâî.
Ïðèìåðû âûøå.
Источник
| Структурная формула, рациональное название и буквенное обозначение | Перенос | Тип |
| 2ē и 2Н+ | П |
| 2ē и 2Н+ | П |
ФМНи ФАД ковалентно связаны с ферментами. Активной группой обоих коферментов является флавин (изоаллоксазин), имеющий сопряженную систему из трех колец, которая может при восстановлении принимать два электрона и два протона.
В ФМН к флавину присоединен фосфорилированный спирт — рибит. ФАД состоит из ФМН, связанного с аденозинмонофосфатом (АМФ). Оба соединения являются функционально близкими коферментами.
| 2ē и 2Н+ | П |
Влипоамиде функцию окислительно-восстановительного центра выполняет внутримолекулярный дисульфидный мостик. Липоевая кислота ковалентно связана с остатком лизина молекулы фермента.
Остаток липоевой кислоты прежде всего участвует в окислительном декарбоксилировании 2-кетокислот.
| 1ē | П |
Группагемаявляется окислительно-восстановительным коферментом в дыхательной цепи, фотосинтезе, а также в монооксигеназах и пероксидазах.
В отличие от гемоглобина в этих случаях ион железа меняет валентность.
Гем в цитохроме С, ковалентно связан с двумя остатками цистеина молекулы фермента.
| 2ē и 1Н+ | P |
Коферменты НАД+иНАДФ+ широко распространены как коферменты дегидрогеназ. Они переносят гидрид-ион(Н‾) и действуют всегдав растворимой форме.
НАД+ передает восстановительный эквивалент из катаболического пути в дыхательную цепь и тем самым участвует в энергетическом обмене. НАДФ+, напротив, является самым важным восстановителемпри биосинтезе.
| 2ē и 2Н+ | Р |
Убихинонявляется переносчиком восстановительных эквивалентовв дыхательной цепи. При восстановлении хинон превращается в ароматический гидрохинон(убихинол).
Аналогичные системы хинон/гидрохинон принимают участие в реакциях фотосинтеза. К этому классу окислительно-восстановительных систем принадлежат также витамины Е и К.
Из сопоставления таблиц 1 и 2, видно, что такие витамины как рибофлавин, липоевая кислота, липоамид, никотиновая кислота и никотинамид являются предшественниками коферментов оксидоредуктаз.
Гем в чистом виде не применяется в медицинской практике из-за сложности его выделения и синтеза. В качестве препарата, содержащего гем, в медицине применяется препарат крови — «гематоген».
Хотя методы синтеза убихинонов разработаны, до настоящего времени окончательно не установлены пути их биосинтеза. Коферменты Q6–Q9 обнаружены в различных микроорганизмах, а кофермент Q10 в человеческом организме. Интересно отметить, что кофермент Q10 в последнее время нашел применение в косметологии.
Аскорбиновую кислоту также целесообразно отнести к растворимому коферменту, поскольку она принимает участие в реакциях окисления некоторых субстратов кислородом, главным образом в реакциях гидроксилирования. Из биохимических процессов с участием аскорбиновой кислоты следует отметить окисление тирозина, синтезы катехоламинов и желчных кислот. Она является коферментом фермента проколлагенпролин-4-диоксигеназы, катализирующего окисление остатков пролина, входящих в структуру проколлагена, до 4-гидроксипролина в процессе созревания коллагена (Аминокислоты и полипептиды: учеб. пособ. Ч. I./ В.А. Смирнов, Ю.Н. Климочкин. – Самара. Самар. гос. техн. ун-т., 2007, стр.10).
В таблице 3 приведены структурные формулы, названия и буквенные обозначения коферментов, участвующих в реакциях переноса функциональных групп, а также соответствующие ферменты и переносимые ими группы.
Источник
Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота.
Примером подклассов могут служить ферменты, действующие на СН-ОН-группу доноров, на СH-СН-группу доноров, на СН-NН2-группу доноров, на гемсодержащие доноры.
Если рассматривать все подклассы, то в них выделяются группы ферментов, действующие на:
1.1. CH-OH группу доноров;
1.2. альдегидную или кетоновую группу доноров;
1.3. CH-СH группу доноров;
1.4. CH-NH2 группу доноров;
1.5. CH-NН группу доноров;
1.6. НАДH или НАДФН в качестве доноров;
1.8. содержащие серу группы доноров;
1.9. гем-содержащие доноры;
1.10. дифенолы в качестве доноров;
1.11. пероксид водорода в качестве акцептора;
1.11. водород в качестве донора;
1.13. один донор с включением молекулярного кислорода;
1.14. два донора с включением молекулярного кислорода;
1.15. супероксидные радикалы в качестве акцептора;
1.17. СН2 группу доноров;
1.18. ферредоксин в качестве донора;
1.19. флаводоксин в качестве донора;
1.20. фосфор или мышьяк в качестве донора;
1.21. на вещества Х-Н и Y-Н с образованием X-Y-связи;
1.22. галоген в качестве донора;
1.97. другие оксидоредуктазы.
На подподклассы деление производится в зависимости от акцептора – НАД+ или НАДФ+ (1.1.1., 1.2.1., 1.3.1., 1.4.1.), дисульфиды (1.2.4.), кислород (1.3.3.). Например, каталаза (КФ 1.11.1.6), пероксидаза (КФ 1.11.1.7).
Наиболее распространены следующие рабочие названия оксидоредуктаз:
1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода.
2. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами.
3. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата.
4. Монооксигеназы – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
5. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
6. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов.
Систематическое название образуется:
Донор электронов : акцептор электронов – оксидоредуктаза.
Пример 1
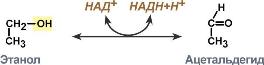
Характеристика фермента
Систематическое название | Алкоголь:НАД-оксидоредуктаза |
Рабочее название | Алкогольдегидрогеназа |
Класс | 1. Оксидоредуктазы |
Подкласс | 1.1. Действующие на СН-ОН-группу доноров |
Подподкласс | 1.1.1. с НАД+ или НАДФ+ в качестве акцептора |
Классификационный номер | КФ 1.1.1.1. |
Кофакторы | Никотинамидадениндинуклеотид. Железо или цинк. |
Пример 2
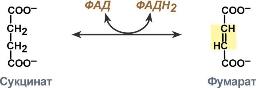
Характеристика фермента
Систематическое название | Сукцинат:ФАД-оксидоредуктаза |
Рабочее название | Сукцинатдегидрогеназа |
Класс | 1. Оксидоредуктазы |
Подкласс | 1.3. Действующие на СН-СН-группу доноров |
Подподкласс | 1.3.99. с ФАД+ в качестве акцептора |
Классификационный номер | КФ 1.3.99.1. |
Кофакторы | Флавинадениндинуклеотид |
Пример 3

Характеристика фермента
Систематическое название | Фенилаланин.Тетрагидробиоптерин:кислород-оксидоредуктаза |
Рабочее название | Фенилаланин-4-монооксигеназа |
Класс | 1. Оксидоредуктазы |
Подкласс | 1.14. Два донора с включением молекулярного кислорода |
Подподкласс | 1.14.16. С восстановленным птеридином в качестве донора и включением одного атома кислорода |
Классификационный номер | КФ 1.14.16.1 |
Кофакторы | Тетрагидробиоптерин. Железо. |
Источник
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Современная классификация ферментов разработана Международным биохимическим союзом (1961г.). В ее основу положен тип катализируемой реакции и механизм. Все ферменты делят на шесть классов: I. Оксидоредуктазы. II. Трансферазы. III. Гидролазы. IV. Лиазы. V. Изомеразы. VI. Лигазы.
Каждый фермент имеет кодовый номер по классификации ферментов: первая цифра характеризует класс реакции, вторая − подкласс, третья − подподкласс, четвертая цифра указывает порядковый номер фермента в его подподклассе. Название фермента состоит из двух частей: в первой части − название субстрата (или субстратов), во второй − тип катализируемой реакции.
Оксидоредуктазы
Оксидоредуктазы катализируют окислительно-восстановительные реакции и подразделяются на 5 основных подклассов:
— оксидазы;
— аэробные дегидрогеназы;
— анаэробные дегидрогеназы;
— гидропероксидазы;
— оксигеназы.
Оксидазы. Катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород. Оксидазы содержат медь, продуктом реакции является вода (исключение составляют реакции, катализируемые уриказой и моноаминоксидазой, в результате которых образуется Н2О2).
Общая схема процесса следующая:
В качестве субстратов оксидаз могут выступать фенолы, полифенолы, амины. Примерами ферментов класса оксидаз являются фенолаза, цитохром-оксидаза, моноаминоксидаза, уриказа.
Фенолаза (катехолоксидаза, тирозиназа) − медьсодержащий фермент с широкой специфичностью. Он катализирует превращение монофенола
(в присутствии о-дифенола) в орто-хинон. Медь содержится также в уриказе, катализирующей окисление мочевой кислоты в аллантоин, и в моноаминоксидазе, окисляющей адреналин и тирамин в митохондриях.
Цитохромоксидаза − гемопротеин, который служит конечным компонентом дыхательной цепи и осуществляет перенос электронов на конечный акцептор − кислород. Данный фермент ингибируется оксидом углерода (II), цианидами и сероводородом. Фермент содержит две молекулы гема, в каждой из которых атом железа может переходить из состояния Fe2+ в состояние Fe3+ и обратно в ходе окисления и восстановления, а также два атома Сu, каждый из которых взаимодействует с одним из гемов.
Аэробные дегидрогеназы. Катализируют удаление водорода из суб-страта, используя в качестве акцептора водорода не только кислород, но и искусственные акцепторы (например, метиленовый синий). Эти дегидрогеназы относятся к флавопротеинам.
В результате реакции образуется пероксид водорода, а не вода:
В качестве кофермента дегидрогеназы содержат ФАД (флавинаденин-динуклеотид) или ФМН (флавинмононуклеотид). Многие флавопротеиновые ферменты содержат несколько ионов металлов.
К ферментам группы аэробных дегидрогеназ относятся: дегидрогеназа L-аминокислот (оксидаза L-аминокислот), катализирующая окислительное дезаминирование природных L-аминокислот, и ксантиндегидрогеназа (ксантиноксидаза), катализирующая окисление ксантина в мочевую кислоту. Молибденсодержащий фермент ксантиноксидаза играет важную роль в катаболизме пуриновых оснований.
Анаэробные дегидрогеназы. Катализируют удаление водорода из субстрата, но не способны использовать кислород в качестве акцептора.
Общая схема процесса следующая:
Анаэробные дегидрогеназы подразделяются в зависимости от природы кофермента на несколько групп.
НАД+-зависимые (пиридинзависимые, первичные) дегидрогеназы, содержащие в качестве кофермента НАД+ или НАДФ+. В общем случае НАД+-зависимые дегидрогеназы катализируют окислительно-восстановительные реакции специфических (например, гликолиза) и общих путей катаболизма (например, цикла Кребса, дыхательной цепи).
Общая схема процесса следующая:
Примером НАД+-зависимых дегидрогеназ могут служить лактатдегидрогеназа, алкогольдегидрогеназа, глутаматдегидрогеназа и др. Например, 1.1.1.27 L-лактат: НАД+-оксидоредуктаза (лактатдегидрогеназа) катализирует взаимопревращение лактата и пирувата:
Пируват L — Лактат
ФАД- и ФМН- зависимые анаэробные дегидрогеназы (флавин-зависимые дегидрогеназы). Первичные флавинзависимые дегидрогеназы переносят восстановительные эквиваленты от субстрата непосредственно на дыхательную цепь. К ним относятся, например, 1.3.99.1 сукцинатдегидрогеназа (СДГ), ацил-КоА-дегидрогеназа и митохондриальная глицерол-3-фосфат-дегидрогеназа:
Вторичная ФМН-зависимая НАДН-дегидрогеназа − компонент дыхательной цепи, переносящий электроны от НАДН к более электроположительным компонентам:
Еще одна функция флавинзависимых дегидрогеназ − катализируемое дигидролипоилдегидрогеназой дегидрирование восстановленного липоата
(промежуточного продукта при окислительном декарбоксилировании пирувата и a-кетоглутарата). При этом вследствие низкого значения окислительно-восстановительного потенциала системы липоата переносчиком водорода от восстановленного липоата к НАД+ является флавопротеин (ФАД).
Цитохромы за исключением цитохромоксидазы классифицируются как анаэробные дегидрогеназы. В дыхательной цепи они служат переносчиками электронов от флавопротеинов к цитохромоксидазе. Цитохромы являются гемопротеинами, у которых атом железа переходит из состояния Fe2+ в Fe3+ и обратно в процессе окисления и восстановления. Помимо дыхательной цепи цитохромы имеются в эндоплазматическом ретикулуме (цитохромы Р-450 и b-5).
Гидропероксидазы. К их числу относятся ферменты пероксидаза и каталаза.
Пероксидаза − фермент, катализирующий окисление пероксидом водорода различных органических соединений − фенолов, аминов, аскорбиновой кислоты, цитохрома С. Пероксидаза обнаружена в растениях, молоке, лейкоцитах, тромбоцитах, а также в тканях, в которых происходит метаболизм эйкозаноидов. Фермент содержит протогем, который в отличие от гемовых групп большинства гемопротеинов слабо связан с апоферментом.
Реакция, катализируемая пероксидазой, имеет сложный характер; суммарная реакция выглядит следующим образом:
В эритроцитах глутатионпероксидаза, содержащая в качестве простетической группы селен, катализирует разложение Н2О2 и гидропероксидов липидов восстановленным глутатионом и, таким образом, защищает липиды мембран и гемоглобин от окисления пероксидами.
Каталаза − это гемопротеин, содержащий 4 гемовые группы. Наряду с пероксидазной активностью каталаза способна использовать одну молекулу Н2О2 в качестве донора электронов, а другую − в качестве акцептора электронов. В организме каталаза в основном разлагает пероксид водорода, образующийся при действии аэробных дегидрогеназ:
Каталаза содержится в крови, костном мозге, мембранах слизистых оболочек, почках и печени.
Во многих тканях, включая и печень, обнаружены микротельца − пероксисомы, которые богаты аэробными дегидрогеназами и каталазой. Биологически выгодно группировать в одном месте как ферменты, приводящие к образованию Н2О2, так и ферменты, разлагающие это соединение.
К ферментам, катализирующим образование Н2О2, кроме пероксисомных ферментов, относятся также митохондриальные и микросомные системы транспорта электронов.
Оксигеназы.
Ферменты этой группы катализируют включение кисло-рода в молекулу субстрата, которое происходит в две стадии:
1) кислород связывается с активным центром фермента;
2) происходит реакция, в результате которой, связанный кислород восстанавливается или переносится на субстрат.
Оксигеназы не относятся к ферментам, которые катализируют реакции, снабжающие клетку энергией; они участвуют в синтезе и деградации многих типов метаболитов, токсинов и ксенобиотиков. Оксигеназы подразделяются на 2 подгруппы.
Монооксигеназы (гидроксилазы). Эти ферменты катализируют включение в субстрат только одного из атомов молекулы кислорода. Другой атом кислорода восстанавливается до воды; для чего необходим дополнительный донор электронов (косубстрат):
субстрат косубстрат
Природа косубстрата может быть различной. Многие оксигеназы используют НАДФН2. В этом случае суммарное уравнение реакции можно записать как
К подобным системам относятся микросомные цитохром-Р-450-содержащие монооксигеназные системы, участвующие в метаболизме многих лекарственных веществ путем их гидроксилирования. Они находятся в микросомах печени вместе с цитохромом Р-450 и цитохромом b-5. Восстановителями этих цитохромов являются НАДН и НАДФН. Цитохромы окисляются субстратами в результате серии ферментативных реакций, составляющих так называемый гидроксилазный цикл:
Лек — лекарственное вещество
К лекарственным веществам, метаболизм которых идет при участии рассматриваемых систем, относятся, например, морфин и бензпирен. Многие лекарственные вещества (например, фенобарбитал) способны индуцировать синтез микросомных ферментов и цитохрома Р-450. Цитохром Р-450 является одновременно гемо- и флавопротеином, причем флавиновые нуклеотиды выступают в качестве второго донора электронов. Цитохром Р-450 в печени осуществляет гидроксилирование липофильных соединений, образующихся в качестве побочных продуктов или попадающих в организм извне (такие вещества объединяют под общим названием «ксенобиотики»). Введение в их молекулы гидроксильных групп повышает гидрофильность этих веществ, понижает токсичность и облегчает их вывод из организма.
Другой пример подобных систем − митохондриальные цитохром-Р-450-содержащие монооксигеназные системы. Они находятся в коре надпочечников, семенниках, яичниках, плаценте, почках и участвуют в биосинтезе стероидных гормонов из холестерина, катализируют гидроксилирование гидроксихолекальциферола, что приводит к образованию активной формы витамина D3 (1,25-дигидроксихолекальциферола). В коре надпочечников содержание митохондриального цитохрома Р-450 в 6 раз выше, чем содержание цитохромов в дыхательной цепи.
Диоксигеназы (истинные оксигеназы). Эти ферменты катализируют включение в молекулу субстрата обоих атомов молекулы кислорода:
Примером служат железосодержащие ферменты 1.13.11.5 гомогентизатдиоксигеназа и 1.13.11.6 3-гидроксиантранилатдиоксигеназа, а также некоторые гемсодержащие ферменты, в частности триптофандиоксигеназа (триптофанпирролаза).
Источник
