Какие витамины входят в состав коферментов оксидоредуктаз
| Структурная формула, рациональное название и буквенное обозначение | Перенос | Тип |
| 2ē и 2Н+ | П |
| 2ē и 2Н+ | П |
ФМНи ФАД ковалентно связаны с ферментами. Активной группой обоих коферментов является флавин (изоаллоксазин), имеющий сопряженную систему из трех колец, которая может при восстановлении принимать два электрона и два протона.
В ФМН к флавину присоединен фосфорилированный спирт — рибит. ФАД состоит из ФМН, связанного с аденозинмонофосфатом (АМФ). Оба соединения являются функционально близкими коферментами.
| 2ē и 2Н+ | П |
Влипоамиде функцию окислительно-восстановительного центра выполняет внутримолекулярный дисульфидный мостик. Липоевая кислота ковалентно связана с остатком лизина молекулы фермента.
Остаток липоевой кислоты прежде всего участвует в окислительном декарбоксилировании 2-кетокислот.
| 1ē | П |
Группагемаявляется окислительно-восстановительным коферментом в дыхательной цепи, фотосинтезе, а также в монооксигеназах и пероксидазах.
В отличие от гемоглобина в этих случаях ион железа меняет валентность.
Гем в цитохроме С, ковалентно связан с двумя остатками цистеина молекулы фермента.
| 2ē и 1Н+ | P |
Коферменты НАД+иНАДФ+ широко распространены как коферменты дегидрогеназ. Они переносят гидрид-ион(Н‾) и действуют всегдав растворимой форме.
НАД+ передает восстановительный эквивалент из катаболического пути в дыхательную цепь и тем самым участвует в энергетическом обмене. НАДФ+, напротив, является самым важным восстановителемпри биосинтезе.
| 2ē и 2Н+ | Р |
Убихинонявляется переносчиком восстановительных эквивалентовв дыхательной цепи. При восстановлении хинон превращается в ароматический гидрохинон(убихинол).
Аналогичные системы хинон/гидрохинон принимают участие в реакциях фотосинтеза. К этому классу окислительно-восстановительных систем принадлежат также витамины Е и К.
Из сопоставления таблиц 1 и 2, видно, что такие витамины как рибофлавин, липоевая кислота, липоамид, никотиновая кислота и никотинамид являются предшественниками коферментов оксидоредуктаз.
Гем в чистом виде не применяется в медицинской практике из-за сложности его выделения и синтеза. В качестве препарата, содержащего гем, в медицине применяется препарат крови — «гематоген».
Хотя методы синтеза убихинонов разработаны, до настоящего времени окончательно не установлены пути их биосинтеза. Коферменты Q6–Q9 обнаружены в различных микроорганизмах, а кофермент Q10 в человеческом организме. Интересно отметить, что кофермент Q10 в последнее время нашел применение в косметологии.
Аскорбиновую кислоту также целесообразно отнести к растворимому коферменту, поскольку она принимает участие в реакциях окисления некоторых субстратов кислородом, главным образом в реакциях гидроксилирования. Из биохимических процессов с участием аскорбиновой кислоты следует отметить окисление тирозина, синтезы катехоламинов и желчных кислот. Она является коферментом фермента проколлагенпролин-4-диоксигеназы, катализирующего окисление остатков пролина, входящих в структуру проколлагена, до 4-гидроксипролина в процессе созревания коллагена (Аминокислоты и полипептиды: учеб. пособ. Ч. I./ В.А. Смирнов, Ю.Н. Климочкин. – Самара. Самар. гос. техн. ун-т., 2007, стр.10).
В таблице 3 приведены структурные формулы, названия и буквенные обозначения коферментов, участвующих в реакциях переноса функциональных групп, а также соответствующие ферменты и переносимые ими группы.
Источник
Àâòîð òåêñòà Àíèñèìîâà Åëåíà Ñåðãååâíà.
Àâòîðñêèå ïðàâà çàùèùåíû. Ïðîäàâàòü òåêñò íåëüçÿ.
Êóðñèâ íå çóáðèòü.
Çàìå÷àíèÿ ìîæíî ïðèñûëàòü ïî ïî÷òå: exam_bch@mail.ru
https://vk.com/bch_5
Ïàðàãðàô ó÷åáíèêà ïî áèîõèìèè 20.2
«Âèäû îêñèäîðåäóêòàç».
ñì. ï.3.
Ñì. òàáëèöó â ôàéëå «20.2 Òàáëèöà îêñèäîðåäóêòàçû».
Îïðåäåëåíèå.
Îêñèäîðåäóêòàçû ýòî êëàññ ôåðìåíòîâ, êîòîðûå êàòàëèçèðóþò îêèñëèòåëüíî-âîññòàíîâèòåëüíûå ðåàêöèè.
Îñíîâíûå ãðóïïû (íå òîëüêî ïîäêëàññû) îêñèäîðåäóêòàç:
äåãèäðîãåíàçû, îêñèäàçû, îêñèãåíàçû,
ðåäóêòàçû, öèòîõðîìû è àíòèîêèñëèòåëüíûå ôåðìåíòû.
×òî òàêîå îêèñëåíèå è âîññòàíîâëåíèå.
Îêèñëåíèå ýòî îòùåïëåíèå ýëåêòðîíà,
à âîññòàíîâëåíèå ýòî ïðèñîåäèíåíèå ýëåêòðîíà.
Îêèñëåíèå è âîññòàíîâëåíèÿ âñåãäà ñîïðÿæåíû, òî åñòü ñâÿçàíû,
ïîòîìó ÷òî åñëè îäíî âåùåñòâî òåðÿåò ýëåêòðîí
è ïðè ýòîì îêèñëÿåòñÿ,
òî äðóãîå âåùåñòâî ýòîò ýëåêòðîí ïðèîáðåòàåò
è ïðè ýòîì âîññòàíàâëèâàåòñÿ.
Ïðè âîññòàíîâëåíèè îðãàíè÷åñêèõ ñóáñòðàòîâ
ýëåêòðîíû ÷àñòî ïðèñîåäèíÿþòñÿ â ñîñòàâå àòîìîâ âîäîðîäà
(êàæäûé èç êîòîðûõ ñîñòîèò èç îäíîãî ýëåêòðîíà è îäíîãî ïðîòîíà),
èñòî÷íèêîì êîòîðûõ ÿâëÿåòñÿ ÍÀÄÔÍ,
êîòîðûé ïîëó÷àåò àòîìû âîäîðîäà â ÏÔÏ (ï.35).
Ïðè îêèñëåíèè îðãàíè÷åñêèõ ñóáñòðàòîâ
ýëåêòðîíû îòùåïëÿþòñÿ îáû÷íî â ñîñòàâå àòîìîâ âîäîðîäà,
êîòîðûå ïåðåíîñÿòñÿ íà êîôåðìåíò (ÍÀÄ è äð.) èëè êèñëîðîä.
Ïðèñîåäèíåíèå àòîìîâ êèñëîðîäà
òîæå ÿâëÿåòñÿ îêèñëåíèåì îðãàíè÷åñêîãî ñóáñòðàòà,
ïîñêîëüêó ïðèñîåäèíèâøèåñÿ àòîìû êèñëîðîäà ïðèòÿãèâàþò ê ñåáå ýëåêòðîííóþ ïëîòíîñòü òåõ àòîìîâ, â êîòîðûì îíè ïðèñîåäèíèëèñü.
1. Ä Å Ã È Ä Ð Î Ã Å Í À Ç Û
êàòàëèçèðóþò ðåàêöèè äåãèäðèðîâàíèÿ,
òî åñòü îòùåïëåíèÿ àòîìîâ âîäîðîäà (Í).
Ïðè ýòîì âîäîðîä
(2 àòîìà âîäîðîäà, ñîñòîÿùèå èç 2 ïðîòîíîâ è 2 ýëåêòðîíîâ)
îòùåïëÿåòñÿ îò îðãàíè÷åñêîãî ñóáñòðàòà (R)
è ïåðåíîñèòñÿ íà êîôåðìåíò (íà ÊîÔ ÍÀÄ+, ÔÀÄ èëè ÍÀÄÔ+).
Ôîðìóëèðóÿ êîðî÷å äåãèäðîãåíàçû ïåðåíîñÿò 2 àòîìà âîäîðîäà
îò ñóáñòðàòà íà êîôåðìåíò.
Ñóáñòðàò äî îòùåïëåíèÿ îò íåãî ïàðû àòîìîâ âîäîðîäà
íàçûâàåòñÿ âîññòàíîâëåííûì ñóáñòðàòîì
è îáîçíà÷àåòñÿ òàê RÍ2;
ãäå Í ýòî àòîìû âîäîðîäà, êîòîðûå áóäóò îòùåïëÿòüñÿ,
à R ýòî îñòàëüíûå àòîìû ìîëåêóëû ñóáñòðàòà.
Ñóáñòðàò ïîñëå îòùåïëåíèÿ îò íåãî ïàðû àòîìîâ âîäîðîäà
îáîçíà÷àåòñÿ òàê R
è íàçûâàåòñÿ îêèñëåííûì.
Êîôåðìåíò, ïîëó÷àþùèé àòîìû âîäîðîäà,
äî èõ ïðèñîåäèíåíèÿ îáîçíà÷àåòñÿ êàê ÊîÔ,
à ïîñëå ïðèñîåäèíåíèÿ äâóõ Í îáîçíà÷àåòñÿ êàê ÊîÔÍ2.
Ïîñêîëüêó ïðè îòùåïëåíèè àòîìîâ âîäîðîäà
âåùåñòâî òåðÿåò âìåñòå ñ âîäîðîäîì
âõîäÿùèå â ñîñòàâ âîäîðîäà ýëåêòðîíû,
à ïîòåðÿ ýëåêòðîíîâ íàçûâàåòñÿ îêèñëåíèåì,
òî RÍ2 áîëåå âîññòàíîâëåííîå âåùåñòâî, ÷åì R,
à ÊîÔÍ2 áîëåå âîññòàíîâëåííîå âåùåñòâî, ÷åì ÊîÔ.
Ïîýòîìó RÍ2 íàçûâàþò âîññòàíîâëåííûì ñóáñòðàòîì,
à R îêèñëåííûì ñóáñòðàòîì.
ÊîÔ2 íàçûâàþò âîññòàíîâëåííûì êîôåðìåíòîì
(âîññòàíîâëåííîé ôîðìîé êîôåðìåíòà),
à ÊîÔ îêèñëåííûì êîôåðìåíòîì
(îêèñëåííîé ôîðìîé êîôåðìåíòà).
Ñõåìà ðåàêöèè, êîòîðàÿ êàòàëèçèðóåòñÿ äåãèäðîãåíàçàìè,
ìîæåò áûòü ïðåäñòàâëåíà â òàêîì âèäå:
RH2 + ÊîÔ ; R + ÊîÔÍ2.
Ãäå RH2 ýòî âîññòàíîâëåííûé ñóáñòðàò
(îðãàíè÷åñêèé ñóáñòðàò äî îòùåïëåíèÿ âîäîðîäà),
ÊîÔ îêèñëåííûé êîôåðìåíò
(êîôåðìåíò äî ïðèñîåäèíåíèÿ ê íåìó îòùåïëåííîãî îò ñóáñòðàòà âîäîðîäà),
R îêèñëåííûé ñóáñòðàò
(îðãàíè÷åñêèé ñóáñòðàò ïîñëå îòùåïëåíèÿ îò íåãî âîäîðîäà),
ÊîÔÍ2 âîññòàíîâëåííûé êîôåðìåíò
(êîôåðìåíò ïîñëå ïðèñîåäèíåíèÿ ê íåìó îòùåïëåííîãî îò ñóáñòðàòà âîäîðîäà).
Êîôåðìåíòû, êîòîðûå ó÷àñòâóþò â ðàáîòå äåãèäðîãåíàç:
ÍÀÄ+, ÔÀÄ è ÍÀÄÔ+.
ÍÀÄ+, ÔÀÄ è ÍÀÄÔ+ ýòî îáîçíà÷åíèÿ îêèñëåííûõ ôîðì êîôåðìåíòîâ,
à ÍÀÄÍ,Í+, ÔÀÄÍ2 è ÍÀÄÔÍ,Í+ ýòî îáîçíà÷åíèÿ âîññòàíîâëåííûõ ôîðì êîôåðìåíòîâ.
ÍÀÄÍ, Í+ è ÔÀÄÍ2 ïåðåíîñÿò âîäîðîä
îò ñóáñòðàòîâ â ÄÖ (äëÿ âûðàáîòêè ÀÒÔ),
à ÍÀÄÔÍ, Í+ ïåðåíîñèò âîäîðîä îò ìåòàáîëèòîâ ÏÔÏ íå â ÄÖ,
à â ðåàêöèè,
êàòàëèçèðóåìûå ðåäóêòàçàìè è ãèäðîêñèëàçàìè.
Äåãèäðîãåíàçû êàòàëèçèðóþò ðåàêöèè
ïðîöåññîâ îêèñëèòåëüíîãî êàòàáîëèçìà.
Ñì. ï.32, 45, 65.
2. Î Ê Ñ È Ä À Ç Û
êàòàëèçèðóþò äåãèäðèðîâàíèå,
ïðè êîòîðîì âîäîðîä, îòùåïëåííûé îò ñóáñòðàòà, ïðèñîåäèíÿåòñÿ ê êèñëîðîäó (Î2).
Ôîðìóëèðóÿ êîðî÷å äåãèäðîãåíàçû ïåðåíîñÿò 2 àòîìà âîäîðîäà
îò ñóáñòðàòà íà êèñëîðîä.
Ñõåìà ðåàêöèè, êîòîðàÿ êàòàëèçèðóåòñÿ îêñèäàçàìè,
ìîæåò áûòü ïðåäñòàâëåíà â òàêîì âèäå:
RH2 + Î2 ; R + Í2Î2.
Ãäå RH2 ýòî âîññòàíîâëåííûé ñóáñòðàò,
R îêèñëåííûé ñóáñòðàò
(îðãàíè÷åñêèé ñóáñòðàò ïîñëå îòùåïëåíèÿ îò íåãî âîäîðîäà).
Êèñëîðîä â ðåçóëüòàòå ýòîé ðåàêöèè âîññòàíàâëèâàåòñÿ.
Äëÿ ðàáîòû îêñèäîðåäóêòàç íóæåí êîôåðìåíò ÔÀÄ
è âèòàìèí Â2 â ñîñòàâå ÔÀÄ.
Îñíîâíûå ïðèìåðû îêñèäàç
ýòî êñàíòèí/îêñèäàçà (ÊñÎ) â ï.71
è ìîíîàìèí/îêñèäàçà (ÌÀÎ) â ï.105.
ÊñÎ ó÷àñòâóåò â êàòàáîëèçìå ïóðèíîâ
(àäåíèíà è ãóàíèíà,
íî ñóáñòðàòû ÊñÎ ãèïîêñàíòèí è êñàíòèí;
ïîä äåéñòâèåì ÊñÎ ãèïîêñàíòèí ïðåâðàùàåòñÿ â êñàíòèí,
à êñàíòèí â ìî÷åâóþ êèñëîòó).
ÌÀÎ ó÷àñòâóåò â îêèñëåíèè àìèíîâ (àäðåíàëèíà, íàïðèìåð).
Èíãèáèòîðû ÊñÎ ïðèìåíÿþòñÿ äëÿ ñíèæåíèÿ âûðàáîòêè óðàòîâ (ñì. ãèïåð/óðèêåìèè),
à èíãèáèòîðû ÌÀÎ ïðèìåíÿþòñÿ â êà÷åñòâå àíòèäåïðåññàíòîâ.
Îêñèäàçû ó÷àñòâóþò â ðåàêöèÿõ ñâîáîäíîãî îêèñëåíèÿ ï.26.
Ñõîäñòâî è îòëè÷èÿ äåãèäðîãåíàç è îêñèäàç:
ñõîäñòâî â òîì, ÷òî êàòàëèçèðóþò îòùåïëåíèå âîäîðîäà (äåãèäðèðîâàíèå),
îòëè÷èÿ â òîì, ÷òî
äåãèäðîãåíàçû ïåðåíîñÿò îòùåïë¸ííûé îò ñóáñòðàòîâ âîäîðîä íà êîôåðìåíòû,
à îêñèäàçû íà êèñëîðîä (îêñè).
3. Î Ê Ñ È Ã Å Í À Ç Û
êàòàëèçèðóþò âêëþ÷åíèå â ìîëåêóëó îðãàíè÷åñêîãî ñóáñòðàòà
àòîìîâ êèñëîðîäà, èñòî÷íèêîì êîòîðûõ ÿâëÿåòñÿ Î2.
Àòîìû êèñëîðîäà âêëþ÷àþòñÿ
ìåæäó àòîìîì âîäîðîäà îðãàíè÷åñêîãî ñóáñòðàòà
è àòîìîì óãëåðîäà ñóáñòðàòà,
ïîýòîìó ìîëåêóëà îðãàíè÷åñêîãî ñóáñòðàòà
äî âêëþ÷åíèÿ â íåå àòîìîâ êèñëîðîäà îêñèãåíàçàìè îáîçíà÷àåòñÿ òàê RÍ,
à ïîñëå âêëþ÷åíèÿ àòîìîâ êèñëîðîäà
ëèáî R-Î-Î-Í (åñëè âêëþ÷åíû îáà àòîìà Î2),
ëèáî R-Î-Í (åñëè âêëþ÷åí îäèí àòîì Î2).
Äèîêñèãåíàçû
3.1). Îêñèãåíàçû, êîòîðûå âêëþ÷àþò â ìîëåêóëó ñóáñòðàòà
îáà àòîìà êèñëîðîäà,
íàçûâàþòñÿ ÄÈîêñèãåíàçàìè;
ñõåìó ðåàêöèè ìîæíî çàïèñàòü òàê:
RH + Î2 ; R-Î-Î-Í.
Ïðîäóêò ðåàêöèè (R-Î-Î-Í)
íàçûâàåòñÿ îðãàíè÷åñêîé ïåðåêèñüþ.
RÎÎÍ áîëåå îêèñëåííîå âåùåñòâî, ÷åì RÍ,
òî åñòü îêèñëÿåòñÿ îðãàíè÷åñêèé ñóáñòðàò,
à âîññòàíàâëèâàåòñÿ êèñëîðîä.
Ìîíîîêñèãåíàçû
3.2). Îêñèãåíàçû, êîòîðûå âêëþ÷àþò â ìîëåêóëó îðãàíè÷åñêîãî ñóáñòðàòà
òîëüêî îäèí àòîì êèñëîðîäà,
íàçûâàþòñÿ ÌÎÍÎîêñèãåíàçàìè èëè ãèäðîêñèëàçàìè.
Âòîðîé àòîì êèñëîðîäà ìîëåêóëû êèñëîðîäà
ñîåäèíÿåòñÿ ñ äâóìÿ àòîìàìè âîäîðîäà, îáðàçóÿ ìîëåêóëó âîäû;
èñòî÷íèêîì àòîìîâ âîäîðîäà â ýòîì ñëó÷àå ÿâëÿåòñÿ êîôåðìåíò
ëèáî ÍÀÄÔÍ, ëèáî àñêîðáàò.
Ñõåìó ðåàêöèè ìîæíî çàïèñàòü òàê:
RH + Î2 + ÊîÔÍ2 ; R-Î-Í + ÊîÔ + Í2Î.
RÍ ýòî ñóáñòðàò, â êîòîðûé äîëæåí âêëþ÷èòüñÿ àòîì êèñëîðîäà,
R-Î-Í ýòî ñóáñòðàò ñî âêëþ÷åííûì â íåãî àòîìîì êèñëîðîäà,
Î2 ýòî èñòî÷íèê àòîìîâ êèñëîðîäà,
ÊîÔÍ2 ýòî èñòî÷íèê àòîìîâ âîäîðîäà.
Ñóáñòðàò RÍ áîëåå âîññòàíîâëåííûé ïî ñðàâíåíèþ ñ RÎÍ.
 ðåàêöèè îêèñëÿþòñÿ RÍ è ÊîÔÍ2,
à âîññòàíàâëèâàåòñÿ êèñëîðîä.
-ÎÍ ýòî ñïèðòîâàÿ (ãèäðîêñèëüíàÿ) ãðóïïà,
à RÎÍ ýòî ñïèðò.
Èç-çà òîãî, ÷òî ïðè äåéñòâèè ìîíîîêñèãåíàç
îáðàçóåòñÿ ãèäðîêñèëüíàÿ ãðóïïà,
ó íèõ åñòü ñèíîíèì ãèäðîêñèëàçû. (Íå ïóòàòü ñ ãèäðîëàçàìè.)
Íóæíî óìåòü íàïèñàòü ðåàêöèè,
êîòîðûå êàòàëèçèðóþò ôåíèëàëàíèí/ãèäðîêñèëàçà
è òèðîçèí/ãèäðîêñèëàçà (ï.105 è 68).
È çíàòü çíà÷åíèå ýòèõ ðåàêöèé.
Îêñèãåíàçû (êàê è îêñèãåíàçû),
ó÷àñòâóþò â ïðîöåññàõ ñâîáîäíîãî îêèñëåíèÿ.
Ó÷àñòâóþò â ìåòàáîëèçìå êñåíîáèîòèêîâ,
â îáìåíå ìíîãèõ ãîðìîíîâ,
â îáðàçîâàíèè êîëëàãåíà.
4. Ð Å Ä Ó Ê Ò À Ç Û
êàòàëèçèðóþò ïðèñîåäèíåíèå âîäîðîäà
ê îðãàíè÷åñêîìó ñóáñòðàòó,
ïðè ýòîì èñòî÷íèêîì àòîìîâ âîäîðîäà ÿâëÿåòñÿ ÍÀÄÔÍ.
Äðóãîé âàðèàíò îïðåäåëåíèÿ
ðåäóêòàçû êàòàëèçèðóþò ïåðåíîñ âîäîðîäà
îò êîôåðìåíòà íà îðãàíè÷åñêèé ñóáñòðàò.
Äåéñòâèå ðåäóêòàç ïðîòèâîïîëîæíî äåéñòâèþ äåãèäðîãåíàç.
Ïðè ïîëó÷åíèè âîäîðîäà ñóáñòðàò âîññòàíàâëèâàåòñÿ,
ïîýòîìó ðåäóêòàçû ìîæíî ñ÷èòàòü âîññòàíîâèòåëÿìè ñóáñòðàòîâ.
Ñõåìà ðåàêöèé, êîòîðûå êàòàëèçèðóþòñÿ ðåäóêòàçàìè:
R + ÊîÔÍ2 ; R + ÊîÔÍ2.
Çäåñü R îðãàíè÷åñêèé ñóáñòðàò äî ïðèñîåäèíåíèÿ âîäîðîäà,
RÍ2 îðãàíè÷åñêèé ñóáñòðàò ïîñëå ïðèñîåäèíåíèÿ ê íåìó àòîìîâ âîäîðîäà,
ÊîÔ2 âîññòàíîâëåííàÿ ôîðìà êîôåðìåíòà (èñòî÷íèê âîäîðîäà),
ÊîÔ îêèñëåííàÿ ôîðìà êîôåðìåíòà.
 ýòîé ðåàêöèè îðãàíè÷åñêèé ñóáñòðàò âîññòàíàâëèâàåòñÿ (ïðèîáðåòàåò âîäîðîä),
à êîôåðìåíò îêèñëÿåòñÿ (òåðÿåò âîäîðîä).
Ðåäóêòàçû îñíîâíûå ôåðìåíòû âîññòàíîâèòåëüíûõ ñèíòåçîâ
íàïðèìåð, ñèíòåçà æèðíûõ êèñëîò,
ñèíòåçà õîëåñòåðèíà (ÃÌÃ-ÊîÀ/ðåäóêòàçà),
ñèíòåçà äåçîêñè/ðèáîíóêëåîòèäîâ (ðèáîíóêëåîòèä/ðåäóêòàçà).
À ãëóòàòèîí/ðåäóêòàçà îòíîñèòñÿ ê àíòèîêèñëèòåëüíûì ôåðìåíòàì ï.27.
5. Ö È Ò Î Õ Ð Î Ì Û
ó÷àñòâóþò â ðåàêöèÿõ èçìåíåíèÿ âàëåíòíîñòè ìåòàëëîâ
íàïðèìåð, â ïðèñîåäèíåíèè ýëåêòðîíà ê èîíó æåëåçà Fe3+.
 ðåçóëüòàòå èîí æåëåçà Fe3+ïðåâðàùàåòñÿ â èîí æåëåçà Fe2+
(âîññòàíîâëåíèå èîíà æåëåçà).
Ñõåìà ðåàêöèè: Fe3+ + å ; Fe2+.
Ïî÷åìó (3+) ïðåâðàùàåòñÿ â (2+) ïðè ïðèñîåäèíåíèè ýëåêòðîíà ïîòîìó ÷òî ó ýëåêòðîíà îòðèöàòåëüíûé çàðÿä.
Ïîëó÷àåòñÿ (3+) + (1-) = (2+).)
 êàêèõ ïðîöåññàõ âñòðå÷àþòñÿ öèòîõðîìû
öèòîõðîìû êàòàëèçèðóþò ðÿä ðåàêöèé äûõàòåëüíîé öåïè ï.22;
íóæíî òàêæå ïîìíèòü öèòîõðîì Ð 450 ï.118.
6. À Í Ò È Î Ê È Ñ Ë È Ò Å Ë Ü Í Û Å Ô Å Ð Ì Å Í Ò Û .
Ñì. ï.27.
Ýòî ôåðìåíòû, êîòîðûå ó÷àñòâóþò â ðàçðóøåíèè àêòèâíûõ ôîðì êèñëîðîäà
è âîññòàíîâëåíèè îêèñëåííûõ èìè âåùåñòâ êëåòêè
(îðãàíè÷åñêèõ ïåðåêèñåé).
Îòíîñÿòñÿ ê àíòèîêèñëèòåëüíîé ñèñòåìå îðãàíèçìà,
ê êîòîðîé òàêæå îòíîñÿòñÿ íèçêîìîëåêóëÿðíûå àíòèîêñèäàíòû
(âèòàìèíû À, Å, Ñ è äðóãèå).
Áëàãîäàðÿ ýòîé ñèñòåìå îðãàíèçì äîëüøå ñîõðàíÿåò ìîëîäîñòü
è äîëüøå íå ïîÿâëÿþòñÿ òàêèå áîëåçíè, êàê àòåðîñêëåðîç, êàòàðàêòà è ò.ä..
Ïîäðîáíåå îá àíòèîêèñëèòåëüíûõ ôåðìåíòàõ ñêàçàíî â îòâåòå íà âîïðîñ ¹ 27.
Ïðèìåðû àíòèîêèñëèòåëüíûõ ôåðìåíòîâ
ñóïåðîêñèä/äèñìóòàçà,
ãëóòàòèîí/ïåðîêñèäàçà, ãëóòàòèîí/òðàíñôåðàçà,
ãëóòàòèîí/ðåäóêòàçà, êàòàëàçà.
Ðåàêöèè, êàòàëèçèðóåìûå îêñèäîðåäóêòàçàìè,
ìîæíî ðàçäåëèòü íà ãðóïïû
ê îäíîé ãðóïïå îòíîñÿòñÿ îêñèäîðåäóêòàçû,
êîòîðûå êàòàëèçèðóþò âîññòàíîâëåíèå îðãàíè÷åñêèõ ñóáñòðàòîâ
(ðåäóêòàçû = âîññòàíîâèòåëè),
à ê äðóãîé îêñèäîðåäóêòàçû, êîòîðûå êàòàëèçèðóþò
îêèñëåíèå îðãàíè÷åñêèõ ñóáñòðàòîâ (âñå, êðîìå ðåäóêòàç).
Îêñèäîðåäóêòàçû, êîòîðûå êàòàëèçèðóþò ðåàêöèè îêèñëåíèÿ îðãàíè÷åñêèõ ñóáñòðàòîâ,
ìîæíî ðàçäåëèòü íà òðè ãðóïïû:
1) êàòàëèçèðóþùèå îòùåïëåíèå âîäîðîäà
(äåãèäðèðîâàíèå) äåãèäðîãåíàçû è îêñèäàçû,
2) êàòàëèçèðóþùèå ïðèñîåäèíåíèå êèñëîðîäà
(îêñèãåíàöèþ) îêñèãåíàçû,
3) êàòàëèçèðóþùèå èçìåíåíèå âàëåíòíîñòè ìåòàëëîâ öèòîõðîìû.
Êàê îïðåäåëèòü, êàêàÿ ôîðìà ñóáñòðàòà áîëåå âîññòàíîâëåííàÿ,
à êàêàÿ áîëåå îêèñëåííàÿ:
÷åì áîëüøå âîäîðîäà â âåùåñòâå,
òåì áîëåå âîññòàíîâëåíî âåùåñòâî;
÷åì áîëüøå êèñëîðîäà â âåùåñòâå,
òåì áîëåå îêèñëåííîå âåùåñòâî.
Ïðèìåðû âûøå.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 19 апреля 2017;
проверки требуют 12 правок.
| Кофермент A | |
|---|---|
| Систематическое наименование | '»`UNIQ--nowiki-00000000-QINU`»‘ |
| Традиционные названия | кофермент A |
| Хим. формула | C21H36N7O16P3S |
| Молярная масса | 767,534 ± 0,031 г/моль |
| Рег. номер CAS | 85-61-0 |
| PubChem | 68163312 |
| Рег. номер EINECS | 201-619-0 |
| SMILES | O=C(NCCS)CCNC(=O)C(O)C(C)(C)COP(=O)(O)OP(=O)(O)OC[C@H]3O[C@@H](n2cnc1c(ncnc12)N)[C@H](O)[C@@H]3OP(=O)(O)O |
| InChI | 1S/C21H36N7O16P3S/c1-21(2,16(31)19(32)24-4-3-12(29)23-5-6-48)8-41-47(38,39)44-46(36,37)40-7-11-15(43-45(33,34)35)14(30)20(42-11)28-10-27-13-17(22)25-9-26-18(13)28/h9-11,14-16,20,30-31,48H,3-8H2,1-2H3,(H,23,29)(H,24,32)(H,36,37)(H,38,39)(H2,22,25,26)(H2,33,34,35)/t11-,14-,15-,16?,20-/m1/s1 RGJOEKWQDUBAIZ-DRCCLKDXSA-N |
| ChEBI | 15346 |
| ChemSpider | 6557 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
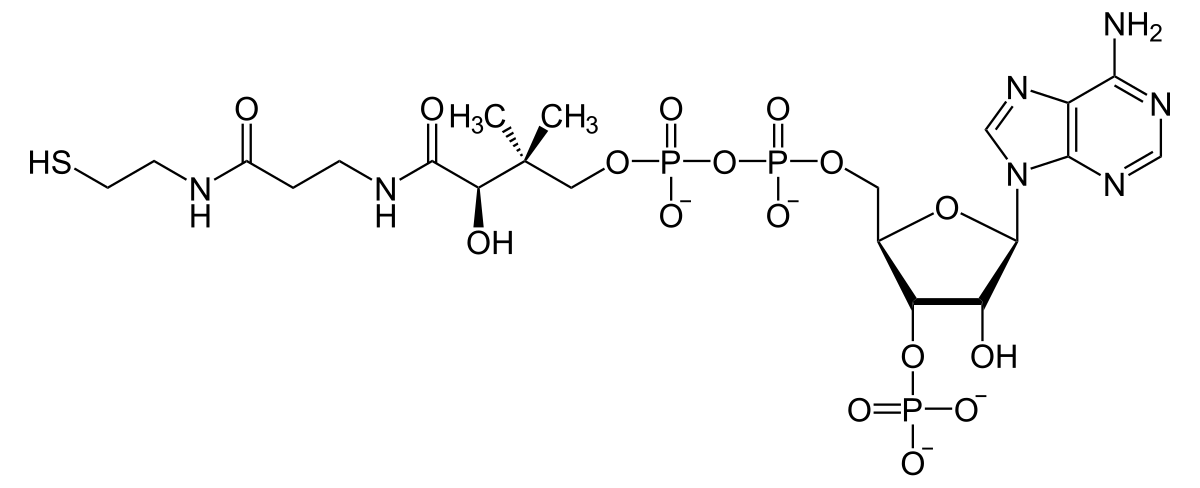
Кофермент A (коэнзим A, КоA, СоА, HSKoA) — кофермент ацетилирования; один из важнейших коферментов, принимающий участие в реакциях переноса ацильных групп при синтезе и окислении жирных кислот и окислении пирувата в цикле лимонной кислоты.[1]
Строение[править | править код]
Молекула кофермента A состоит из остатка адениловой кислоты (1), связанной пирофосфатной группой (2) с остатком пантоевой кислоты (3), которая в свою очередь связана амидной связью с аминокислотой β-аланином (4) (эти две группы представляют собой остаток пантотеновой кислоты), соединённой амидной связью с остатком β-меркаптоэтаноламина (5).
Биосинтез[править | править код]
Кофермент A синтезируется в пять этапов из пантотеновой кислоты (витамина B5) и цистеина:
- Пантотеновая кислота фосфорилируется в 4′-фосфопантотенат с помощью фермента пантотенаткиназы
- Цистеин присоединяется к 4′-фосфопантотенату с помощью фермента фосфопантотеноилцистеинсинтетазы с образованием 4′-фосфо-N-пантотеноилцистеина
- 4′-фосфо-N-пантотеноилцистеин декарбоксилируется с образованием 4′-фосфопантотеина с помощью фермента фосфопантотеноилцистеиндекарбоксилазы
- 4′-фосфопантотеин с адениловой кислотой формирует дефосфо-КоA под действием фермента фосфопантотеинаденилтрансферазы
- Наконец, дефосфо-КоA фосфорилируется АТФ в кофермент A с помощью фермента дефосфокоэнзимкиназы.
Биохимическая роль[править | править код]
С КоА связан ряд биохимических реакций, лежащих в основе окисления и синтеза жирных кислот, биосинтеза жиров, окислительных превращений продуктов распада углеводов. Во всех случаях КоA действует в качестве промежуточного звена, связывающего и переносящего кислотные остатки на другие вещества. При этом кислотные остатки в составе соединения с КоA подвергаются тем или иным превращениям, либо передаются без изменений на определённые метаболиты.
История открытия[править | править код]
Впервые кофермент был выделен из печени голубя в 1947 году Ф. Липманом[2]. Структура кофермента A была определена в начале 1950-х годов Ф. Линеном в Институте Листера в Лондоне. Полный синтез КоA осуществил в 1961 году X. Корана.
Список ацил-КоA[править | править код]
Из природных соединений выделены и идентифицированы различные ацильные производные кофермента A:
Ацил-КоA из карбоновых кислот:
- Ацетил-КоА
- Пропионил-КоА
- Ацетоацетил-КоА
- Кумарол-КоА
- Бутирил-КоА
Ацил-КоА из дикарбоновых кислот:
- Малонил-КоА
- Сукцинил-КоА
- Гидроксиметилглютарил-КоА
- Пименил-КоА
Ацил-КоА из карбоциклических кислот:
- Бензоил-КоА
- Фенилацетил-КоА
Существуют также разнообразные ацил-КоА жирных кислот, которые играют большую роль в качестве субстратов для реакций синтеза липидов.
См. также[править | править код]
- Витамин B5
Примечания[править | править код]
- ↑ Овчинников Ю. А. Биоорганическая химия / Ю. А. Овчинников. — М.: Просвещение, 1987. — 815 с., ил.
- ↑ Baddiley, J.; Thain, E. M.; Novelli, G. D.; Lipmann, F. Structure of Coenzyme A (англ.) // Nature : journal. — 1953. — Vol. 171, no. 4341. — P. 76. — doi:10.1038/171076a0.
Литература[править | править код]
- Филиппович, Ю. Б. Основы биохимии: Учеб. для хим. и биол. спец. пед. ун-тов и ин-тов / Ю. Б. Филиппович. — 4-е изд., перераб. и доп. — М.: «Агар», 1999. — 512 с., ил.
- Березов, Т. Т. Биологическая химия: Учебник / Т. Т. Березов, Б. Ф. Коровкин. — 3-е изд., перераб. и доп. — М.: Медицина, 1998. — 704 с., ил.
- Овчинников, Ю. А. Биоорганическая химия / Ю. А. Овчинников. — М.: Просвещение, 1987. — 815 с., ил.
- Племенков, В. В. Введение в химию природных соединений / В. В. Племенков. — Казань: КГУ, 2001. — 376 с.
Источник
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
— ковалентными связями;
— ионными связями;
— гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы– производные витаминов или химические модификации витаминов.
1 группа: тиаминовые – производные витамина В1. Сюда относят:
— тиаминмонофосфат (ТМФ);
— тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
— тиаминтрифосфат (ТТФ).
ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, a-кетоглутаровая кислота. Этот фермент катализирует отщепление СО2.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
— флавинмононуклеотид (ФМН);
— флавинадениндинуклеотид (ФАД).
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
[рис. изоалоксазиновое кольцо соединено с ребитолом, ребитол с фосфорной к-той, а фосфорная к-та – с АМФ]
ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2-COOH® (над стрелкой – СДГ, под – ФАД и ФАДН2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах.
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую.
4 группа: никотинамидные, производные витамина РР — никотинамида:
Представители:
— никотинамидадениндинуклеотид (НАД);
— никотинамидадениндинуклеотидфосфат (НАДФ).
Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2.
Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н+]
5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат]
— пиридоксин;
— пиридоксаль;
— пиридоксамин.
Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ).
ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК.
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH«(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu2+ — амилазы, Mg2+ — АТФ-азы (например, миозиновой АТФ-азы).
Могут участвовать в:
-присоединении субстратного комплекса фермента;
-в катализе;
-стабилизация оптимальной конформации активного центра фермента;
-стабилизация четвертичной структуры.
Источник
