Какие витамины участвуют в синтезе гема
Учитывая, что
белковая часть молекулы гемоглобина (глобин) синтезируется, как и все остальные
белки, далее подробно рассмотрен биосинтез его простетической группы, т.е.
синтез тетрапиррольного соединения – гема (см. главу 2).
К настоящему
времени почти полностью выяснены основные пути образования порфиринов и
протопорфиринов, являющихся непосредственными предшественниками гема и
хлорофилла. Благодаря исследованиям Д. Шемина и др. выяснены основные пути
синтеза гема. С помощью меченых предшественников было показано, что в синтезе
гема в бесклеточных экстрактах эритроцитов птиц специфическое участие принимают
глицин, уксусная и янтарная кислоты. Источником всех 4 атомов азота и 8 атомов
углерода тетрапиррольного кольца оказался глицин, а источником остальных 26 из
34 атомов углерода – янтарная кислота (сук-цинат), точнее ее производное
сукцинил-КоА. Последовательность химических реакций синтеза тетрапирролов в
организме животных можно условно разделить на несколько стадий.
На I стадии,
протекающей в 2 этапа, сукцинил-КоА взаимодействует с глицином и образованием
δ-аминолевулиновой кислоты (δ-АЛК).
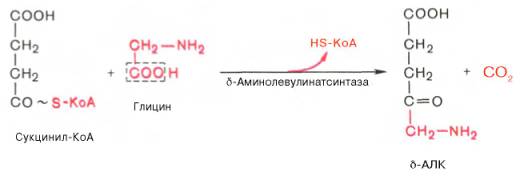
Эту стадию
катализирует специфический пиридоксальфосфатзависимый фермент
δ-аминолевулинатсинтаза – ключевой, аллостерический фермент синтеза тетрапирролов.
Впервые эта
синтаза была обнаружена в эндоплазматической сети клеток печени.
Фермент индуцируется стероидами и другими факторами и ингибируется по типу
обратной связи конечным продуктом биосинтеза – гемом.
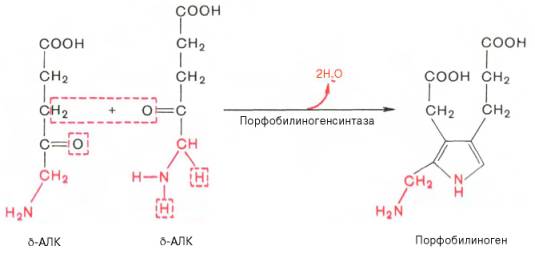
На II стадии
происходит конденсация 2 молекул δ-аминолевулиновой кислоты с образованием
первого монопиррольного соединения – порфо-билиногена (ПБГ).

Фермент,
катализирующий эту стадию,– порфобилиногенсинтаза также является регуляторным
ферментом, подвергаясь ингибированию конечными продуктами синтеза. Предполагают,
что механизм этой сложной реакции дегидратации включает образование кетиминной
связи (шиффово основание) между кетогруппой одной молекулы
δ-аминолевулиновой кислоты и δ-аминогруппой лизина молекулы фермента.
В следующей многоступенчатой стадии, катализируемой соответствующими
ферментами, из 4 монопиррольных молекул порфобилиногена синтезируется
тетра-пиррольный комплекс протопорфирин IX, являющийся непосредственным
предшественником гема. Некоторые этапы сложного пути синтеза окончательно не установлены.
В
заключительной стадии протопорфирин IX присоединяет молекулу железа при участии
феррохелатазы (гемсинтазы), и образуется гем. Последний используется для
биосинтеза всех гемсодержащих хромопро-теинов.
Источником
железа для этой реакции является ферритин, который считается резервным
гемопротеином, откладывающимся в клетках костного мозга, печени и селезенки.
Имеются
указания, что, помимо железа, в синтезе гема участвуют некоторые кофакторы, в
частности витамин В12, ионы меди, хотя конкретная их роль не
раскрыта.
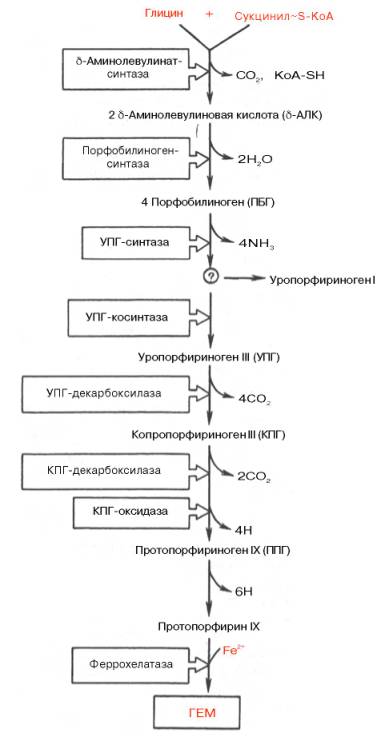
Таким
образом, весь путь синтеза гема может быть представлен в виде схемы, в которой
даны полные и сокращенные обозначения промежуточных метаболитов и ферментов.
Источник
Гем является небелковой частью многих гемопротеинов:
- гемоглобин (до 85% общего количества гема организма), локализованный в эритроцитах и клетках костного мозга,
- миоглобин скелетных мышц и миокарда (до 17%),
- цитохромы дыхательной цепи,
- ферменты цитохромоксидаза, цитохром P450, гомогентизатоксидаза, миелопероксидаза, каталаза и глутатионпероксидаза, тиреопероксидаза и т.д. – менее 1%.
Строение и синтез гема
Гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
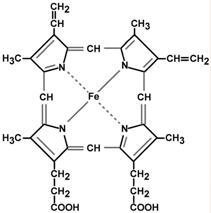
Строение гема
Синтез гема в основном идет в предшественниках эритроцитов, в клетках печени, почек, слизистой кишечника и в остальных тканях. Первая реакция синтеза с участием δ-аминолевулинат-синтазы (греч. δ — «дельта») происходит в митохондриях. Следующая реакция при участии аминолевулинатдегидратазы (порфобилиноген-синтазы) протекает в цитозоле, здесь из двух молекул δ‑аминолевулиновой кислоты образуется циклический порфобилиноген (монопиррол).
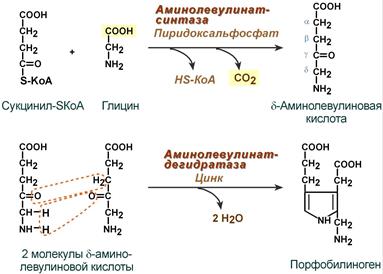
Синтез порфобилиногена
После синтеза порфобилиногена четыре его молекулы конденсируются в гидроксиметилбилан, который далее превращается в уропорфириноген типа I и уропорфириноген типа III. В синтезе обоих видов порфиринов принимает участие уропорфириноген I-синтаза, в образовании уропорфириногена III дополнительно принимает участие фермент уропорфириноген III-косинтаза.
Судьба обоих типов уропорфириногена двояка: они могут окисляться до уропорфирина (на рисунке не показано) или декарбоксилироваться до копропорфириногена соответствующего типа.
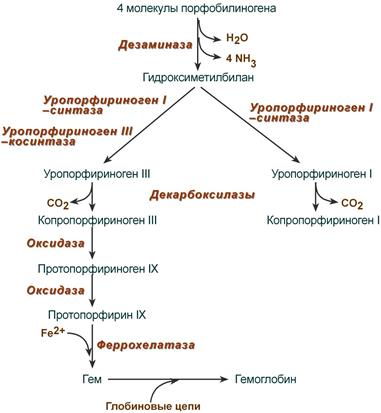
Синтез гема из порфобилиногена
Копропорфириноген III возвращается в митохондрии и окисляется в протопорфириноген IX и далее в протопорфирин IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза (гемсинтаза).
Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез «своих» белков.
Названия пигментов (уропорфирины и копропорфирины) были даны веществам по источнику их первоначального выделения, при этом восстановленные бесцветные формы называют порфириногенами. Для порфиринов характерно наличие изомерии вследствие различного расположения радикалов, что нашло отражение в порядковых номерах изомеров.
Регуляция синтеза гема
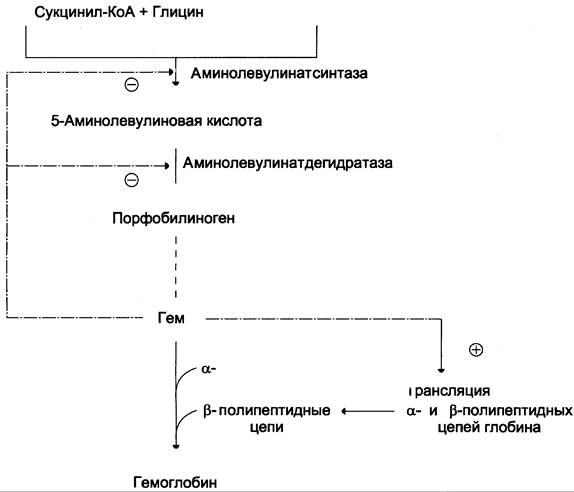
Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза.
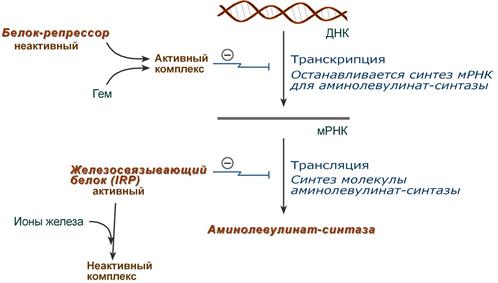
1. Гем :
- напрямую оказывает отрицательный аллостерический эффект на фермент,
- влияет на транскрипцию фермента. После взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется и синтез фермента прекращается.
2. Ионы железа. Их достаточное количество оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы.
В клетке имеется железосвязывающий белок (англ. IRP, iron-responsive element-binding proteins – белок, связывающий железочувствительный элемент), который в отсутствии ионов железа обладает сродством к железочувствительному участку IRE (англ. iron-responsive element ) на матричной РНК фермента. Это связывание блокирует трансляцию мРНК в рибосоме, т.е. подавляет синтез белковой цепи.
При наличии ионов железа они связываются с железосвязывающим белком, образуя с ним неактивный комплекс, и это инициирует синтез фермента.
3. Положительным модулятором аминолевулинатсинтазы служит внутриклеточная гипоксия, которая в эритропоэтических тканях индуцирует синтез фермента.
4. В печени повышению активности аминолевулинатсинтазы способствуют различные соединения, усиливающие работу микросомальной системы окисления (жирорастворимые вещества, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, и снижается внутриклеточная концентрация свободного гема. В результате происходит усиление синтеза фермента.
Источник
РАЗДЕЛ 13. МЕТАБОЛИЗМ ГЕМА И ОБМЕН ЖЕЛЕЗА
Гем является простетической группой многих белков: гемоглобина, миоглобина, цитохромов митохондриальной ЦПЭ, цитохрома Р450, участвующего в микросомальном окислении. Ферменты каталаза, пероксидаза, цитохромоксидаза содержат гем в качестве кофермента.
Все клетки организма имеют гемсодержащие белки, поэтому синтез гема идёт во всех клетках, за исключением эритроцитов, не имеющих, как известно, белоксинтезирующей системы.
При распаде гема в клетках РЭС образуется жёлчный пигмент билирубин. Дальнейший катаболизм билирубина в печени, кишечнике и почках приводит к образованию конечных продуктов распада гема стеркобилина и уробилина, содержащихся, соответственно, в кале и моче. Железо, освобождающееся при распаде гема, снова используется для синтеза железосодержащих белков.
I. Строение и биосинтез гема
А. Строение гема
Гем состоит из иона двухвалентного железа и порфирина (рис. 13-1). В основе структуры порфиринов находится порфин. Порфин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостиками (рис. 13-1). В зависимости от структуры заместителей в кольцах пирролов различают несколько типов порфиринов: протопорфирины, этиопорфирины, мезопорфирины и копропорфирины. Протопорфирины — предшественники всех других типов порфиринов.
Рис. 13-1. Строение порфина (А), протопорфирина IX (Б) и гема гемоглобина (В). Порфин — циклическая структура, состоящая из четырёх пиррольных колец, связанных между собой метеновыми мостиками. Протопорфирин IX имеет четыре метильных, два винильных радикала и два остатка пропионовой кислоты. В геме гемоглобина Fе2+ образует две ковалентные и две координационные связи с атомами азота пиррольных колец протопорфирина IX.

Гемы разных белков могут содержать разные типы порфиринов (см. раздел 6). В геме гемоглобина находится протопорфирин IX, который имеет 4 метальных, 2 винильных радикала и 2 остатка пропионовой кислоты. Железо в геме находится в восстановленном состоянии (Fе+2) и связано двумя ковалентными и двумя координационными связями с атомами азота пиррольных колец. При окислении железа гем превращается в гематин (Fе3+). Наибольшее количество гема содержат эритроциты, заполненные гемоглобином, мышечные клетки, имеющие миоглобин, и клетки печени из-за высокого содержания в них цитохрома Р450.
Б. Биосинтез гема
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени (рис. 13-2). В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах — для образования цитохрома Р450.
Рис. 13-2. Синтез гема. Цифрами на схеме указаны ферменты: 1 — аминолевулинатсинтаза; 2 — аминолевулинатдегидратаза; 3 — порфобилиногендезаминаза; 4 — уропорфириноген III косинтаза; 5 — уропорфириногендекарбоксилаза; 6 — копропорфириноген III оксидаза; 7 — протопорфириногеноксидаза; 8 — феррохелатаза. Буквами обозначены заместители в пиррольных кольцах: М — метил, В — винил, П — остатки пропионовой кислоты, А — ацетил, ПФ — пиридоксальфосфат. Донором железа служит депонирующий железо в клетках белок ферритин.

Первая реакция синтеза гема — образование 5-аминолевулиновой кислоты из глицина и сукцинил-КоА (рис. 13-3) идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции — сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза.
Рис. 13-3. Реакция образования 5-аминолевулиновой кислоты.

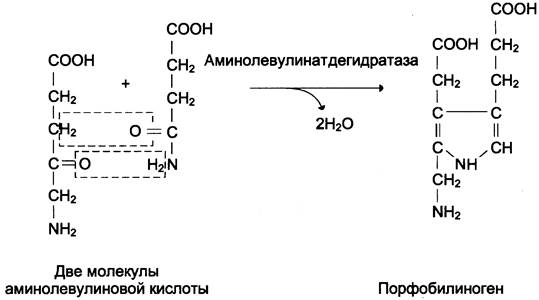
Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты в молекулу порфобилиногена (рис. 13-4), дезаминирование порфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор- фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Гидроксиметилбилан может также неферментативно превращаться в уропорфириноген I, который декарбоксилируется в копропорфириноген I. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходят заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириноген IX, а протопорфириноген IX — в протопорфирин IX. Фермент феррохелатаза, присоединяя к протопорфирину IX двухвалентное железо, превращает его в гем (рис. 13-2). Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с α- и β-полипепептидными цепями глобина, образует гемоглобин. Гем регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится.
Рис. 13-4. Реакция образования порфобилиногена.
В. Регуляция биосинтеза гема
Регуляторную реакцию синтеза гема катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Скорость реакции регулируется аллостерически и на уровне трансляции фермента.
Аллостерическим ингибитором и корепрессором синтеза аминолевулинатсинтазы является гем (рис. 13-5).
Рис. 13-5. Регуляция синтеза гема и гемоглобина. Гем по принципу отрицательной обратной связи ингибирует аминолевулинатсинтазу и аминолевулинатдегидратазу и является индуктором трансляции α- и β-цепей гемоглобина.
В ретикулоцитах синтез этого фермента на этапе трансляции регулирует железо. На участке инициации мРНК, кодирующей фермент, имеется последовательность нуклеотидов, образующая шпилечную петлю, которая называется железочувствительным элементом (от англ. iron- responsive element, IRE) (рис. 13-6).
Рис. 13-6. Регуляция синтеза аминолевулинатсинтазы. А — при высокой концентрации железа в ретикулоцитах оно присоединяется к железосвязывающему белку и снижает сродство этого белка к железочувствительному элементу (IRE) матричной РНК, кодирующей аминолевулинатсинтазу. Белковые факторы инициации трансляции связываются с мРНК и инициируют трансляцию аминолевулинатсинтазы. Б — при низком содержании железа в ретикулоцитах железосвязывающий белок обладает высоким сродством к IRE и взаимодействует с ним. Белковые факторы инициации трансляции не могут присоединиться к мРНК, и трансляция прекращается.
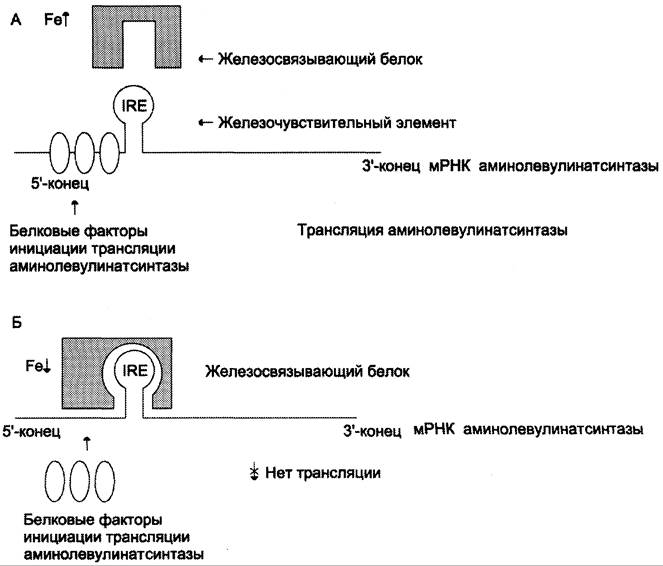
При высоких концентрациях железа в клетках оно образует комплекс с остатками цистеина регуляторного железосвязывающего белка. Взаимодействие железа с регуляторным железосвязывающим белком вызывает снижение сродства этого белка к IRE-элементу мРНК, кодирующей аминолевулинатсинтазу, и продолжение трансляции (рис. 13-6, А). При низких концентрациях железа железосвязывающий белок присоединяется к железочувствительному элементу, находящемуся на 5′-нетранслируемом конце мРНК, и трансляция аминолевулинатсинтазы тормозится (рис. 13-6, Б).
Аминолевулинатдегидратаза также аллостерически ингибируется гемом, но так как активность этого фермента почти в 80 раз превышает активность аминолевулинатсинтазы, то это не имеет большого физиологического значения.
Дефицит пиридоксальфосфата и лекарственные препараты, которые являются его структурными аналогами, снижают активность аминолевулинатсинтазы.
Г. Нарушения биосинтеза гема. Порфирии
Наследственные и приобретённые нарушения синтеза гема, сопровождающиеся повышением содержания порфириногенов, а также продуктов их окисления в тканях и крови и появлением их в моче, называют порфириями («порфирин» в переводе с греч. означает пурпурный).
Наследственные порфирии обусловлены генетическими дефектами ферментов, участвующих в синтезе гема, за исключением аминолевулинатсинтазы. При этих заболеваниях отмечают снижение образования гема. Поскольку гем — аллостерический ингибитор аминолевулинатсинтазы, то активность этого фермента повышается, и это приводит к накоплению промежуточных продуктов синтеза гема — аминолевулиновой кислоты и порфириногенов.
В зависимости от основной локализации патологического процесса различают печёночные и эрйтропоэтические наследственные порфирии. Эритропоэтические порфирии сопровождаются накоплением порфиринов в нормобластах и эритроцитах, а печёночные — в гепатоцитах.
При тяжёлых формах порфирий наблюдают нейропсихические расстройства, нарушения функций РЭС, повреждения кожи. Порфириногены не окрашены и не флуоресцируют, но на свету они легко превращаются в порфири- ны. Последние проявляют интенсивную красную флуоресценцию в ультрафиолетовых лучах. В коже на солнце в результате взаимодействия с порфиринами кислород переходит в синглетное состояние. Синглетный кислород вызывает ускорение ПОЛ клеточных мембран и разрушение клеток, поэтому порфирии часто сопровождаются фотосенсибилизацией и изъязвлением открытых участков кожи. Нейропсихические расстройства при порфириях связаны с тем, что аминолевулинат и порфириногены являются нейротоксинами.
Иногда при лёгких формах наследственных порфирий заболевание может протекать бессимптомно, но приём лекарств, являющихся индукторами синтеза аминолевулинатсинтазы, может вызвать обострение болезни. Индукторами синтеза аминолевулинатсинтазы являются такие известные лекарства, как сульфаниламиды, барбитураты, диклофенак, вольтарен, стероиды, гестагены. В некоторых случаях симптомы болезни не проявляются до периода полового созревания, когда повышение образования β-стероидов вызывает индукцию синтеза аминолевулинатсинтазы. Порфирии наблюдают и при отравлениях солями свинца, так как свинец ингибирует аминолевулинатдегидратазу и феррохелатазу. Некоторые галогенсодержащие гербициды и инсектициды являются индукторами синтеза аминолевулинатсинтазы, поэтому попадание их в организм сопровождается симптомами порфирии.
Источник
В ретикулоцитах происходит координированный синтез a и b-пептидных цепей гемоглобина, а также синтез его простетической группы, так, что ни один из этих компонентов не образуется в избыточном или недостаточном количествах. Учитывая, что белковая часть молекулы гемоглобина (глобин) синтезируется, как и все остальные белки, далее подробно рассмотрен биосинтез его простетической группы, т.е. синтез тетрапиррольного соединения − гема. Гем, железосодержащее тетрагидропиррольное красящее вещество, является составной частью О2-связывающих белков и различных коферментов оксидоредуктаз. Почти на 85% биосинтез гема происходит в костном мозге, и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма.
К настоящему времени почти полностью выяснены основные пути образования порфиринов и протопорфиринов, являющихся непосредственными предшественниками гема и хлорофилла. Источником всех 4 атомов азота и 8 атомов углерода тетрапиррольного кольца оказался глицин, а источником остальных 26 из 34 атомов углерода − янтарная кислота (сукцинат), точнее ее производное сукцинил-КоА. Последовательность химических реакций синтеза тетрапирролов в организме животных можно условно разделить на несколько стадий.
На I стадии, протекающей в 2 этапа в митохондриях, сукцинил-КоА взаимодействует с глицином и образованием δ-аминолевулиновой кислоты (δ -АЛК).

Эту стадию катализирует специфический пиридоксальфосфатзависимый фермент δ –аминолевулинатсинтаза − ключевой, аллостерический фермент синтеза тетрапирролов.
Впервые эта синтаза была обнаружена в эндоплазматической сети клеток печени. Фермент индуцируется стероидами и другими факторами и ингибируется по типу обратной связи конечным продуктом биосинтеза − гемом.
После синтеза δ-аминолевулинат переходит из митохондрий в цитоплазму и на II стадии происходит конденсация 2 молекул δ-аминолевулиновой кислоты с образованием первого монопиррольного соединения − порфобилиногена (ПБГ).

Фермент, катализирующий эту стадию − порфобилиногенсинтаза также является регуляторным ферментом, подвергаясь ингибированию конечными продуктами синтеза. Кроме того, порфобилиногенсинтаза ингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината.
В следующей многоступенчатой стадии, катализируемой соответствующими ферментами, из 4 монопиррольных молекул порфобилиногена синтезируется тетра-пиррольный комплекс уропорфириноген, который затем модифицируется в протопорфирин IX, являющийся непосредственным предшественником гема. Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Образующийся копропорфириноген III снова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Модификация боковых цепей заканчивается образованием протопорфириногена IX. На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов.
В заключительной стадии протопорфирин IX присоединяет молекулу железа при участии феррохелатазы (гемсинтазы), и образуется гем (или Fe-протопорфирин IX). Последний используется для биосинтеза всех гемсодержащих хромопротеинов, например включается, в гемоглобин и миоглобин, где он связан нековалентно, или в цитохром С, с которым связывается ковалентно.

Источником железа для этой реакции является ферритин, который считается резервным гемопротеином, откладывающимся в клетках костного мозга, печени и селезенки.
Имеются указания, что, помимо железа, в синтезе гема участвуют некоторые кофакторы, в частности витамин В12, ионы меди, хотя конкретная их роль не раскрыта.
Таким образом, весь путь синтеза гема может быть представлен в виде схемы, в которой даны полные и сокращенные обозначения промежуточных метаболитов и ферментов.

Оба фермента, участвующие в синтезе порфобилиногена из глицина и сукцинил-КоА, являются регулируемыми ферментами; они ингибируются гемом и гемоглобином. С другой стороны, синтез пептидных цепей гемоглобина происходит только в присутствии гема, и образующиеся пептидные цепи тут же соединяются с гемом. При низкой концентрации гема активируется ингибитор инициации белкового синтеза в ретикулоцитах и синтез глобина замедляется. Известны наследственные анемии, связанные с дефектами ферментов, участвующих в синтезе гемма. При этом в организме нередко образуются избыточные количества окрашенных порфиринов − предшественников гема. Такие формы нарушения обмена гемма называют порфириями; некоторые из них протекают очень тяжело. Многие из этих заболеваний приводят к выделению предшественников гема с калом или мочой, которая вследствие этого может быть окрашена в темно-красный цвет. Также наблюдается отложение порфиринов, обладающих фотосенсибилизацией в коже. При воздействии света это приводит к образованию трудноизлечимых волдырей. При порфириях часты также неврологические нарушения. Возможно, что в основе средневековых легенд о людях-вампирах (дракулах) лежит странное поведение больных порфириями (светобоязнь, необычные внешность и поведение, употребление крови в пищу, компенсирующее дефицит гема и зачастую улучшающее состояние при некоторых формах порфирий).
Источник