Фмн в какой витамин входит

Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
— ковалентными связями;
— ионными связями;
— гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы– производные витаминов или химические модификации витаминов.
1 группа: тиаминовые – производные витамина В1. Сюда относят:
— тиаминмонофосфат (ТМФ);
— тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
— тиаминтрифосфат (ТТФ).
ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, a-кетоглутаровая кислота. Этот фермент катализирует отщепление СО2.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
— флавинмононуклеотид (ФМН);
— флавинадениндинуклеотид (ФАД).
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
[рис. изоалоксазиновое кольцо соединено с ребитолом, ребитол с фосфорной к-той, а фосфорная к-та – с АМФ]
ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2-COOH® (над стрелкой – СДГ, под – ФАД и ФАДН2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах.
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую.
4 группа: никотинамидные, производные витамина РР — никотинамида:
Представители:
— никотинамидадениндинуклеотид (НАД);
— никотинамидадениндинуклеотидфосфат (НАДФ).
Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2.
Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н+]
5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат]
— пиридоксин;
— пиридоксаль;
— пиридоксамин.
Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ).
ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК.
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH«(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu2+ — амилазы, Mg2+ — АТФ-азы (например, миозиновой АТФ-азы).
Могут участвовать в:
-присоединении субстратного комплекса фермента;
-в катализе;
-стабилизация оптимальной конформации активного центра фермента;
-стабилизация четвертичной структуры.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 января 2017;
проверки требуют 27 правок.
| Рибофлавин | |
|---|---|
| Систематическое наименование | Рибофлавин; лактофлавин; витамин B2; E101 |
| Хим. формула | C17H20N4O6 |
| Молярная масса | 376,37 г/моль |
| Температура | |
| • плавления | 282 °C |
| Растворимость | |
| • в воде | 0,11 мг/мл при 27,5 °C |
| • в ацетоне | нерастворимы |
| • в диэтиловом эфире | нерастворимы |
| • в хлороформе | нерастворимы |
| • в бензоле | нерастворимы |
| Рег. номер CAS | 83-88-5 |
| PubChem | 493570 |
| Рег. номер EINECS | 201-507-1 |
| SMILES | CC1=CC2=C(C=C1C)N(C3=NC(=O)NC(=O)C3=N2)CC(C(C(CO)O)O)O |
| InChI | 1S/C17H20N4O6/c1-7-3-9-10(4-8(7)2)21(5-11(23)14(25)12(24)6-22)15-13(18-9)16(26)20-17(27)19-15/h3-4,11-12,14,22-25H,5-6H2,1-2H3,(H,20,26,27)/t11-,12+,14-/m0/s1 AUNGANRZJHBGPY-SCRDCRAPSA-N |
| Кодекс Алиментариус | E101 |
| ChEBI | 17015 |
| ChemSpider | 431981 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Рибофлави́н (лактофлавин, витамин B2) — один из наиболее важных водорастворимых витаминов, кофермент многих биохимических процессов. Используется в качестве пищевого красителя, входит в Кодекс Алиментариус под кодом E101.
Физические свойства[править | править код]
Рибофлавин представляет собой игольчатые кристаллы жёлто-оранжевого цвета, собранные в друзы, горького вкуса. Рибофлавин является производным гетероциклического соединения изоаллоксазина, связанного с многоатомным спиртом рибитом.
Хорошо[1]растворим в воде, устойчив в кислых растворах, но легко разрушается в нейтральных и щелочных. Чувствителен к видимому и УФ-излучению и сравнительно легко подвергается обратимому восстановлению.
Химические свойства[править | править код]
Рибофлавин является биологически активным веществом, играющим важную роль в поддержании здоровья человека. Биологическая роль рибофлавина определяется вхождением его производных флавинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД) в состав большого числа важнейших окислительно-восстановительных ферментов в качестве коферментов.
Флавиновые ферменты принимают участие в окислении жирных, янтарной и других кислот; инактивируют и окисляют высокотоксичные альдегиды, расщепляют в организме чужеродные D-изомеры аминокислот, образующиеся в результате жизнедеятельности бактерий; участвуют в синтезе коферментных форм витамина B6 и фолацина; поддерживают в восстановленном состоянии глутатион и гемоглобин.
В ферментах коферменты функционируют как промежуточные переносчики электронов и протонов, отщепляемых от окисляемого субстрата.
Недостаток рибофлавина в организме человека[править | править код]
Витамин B2 необходим для образования эритроцитов, антител, для регуляции роста и репродуктивных функций в организме. Он также необходим для здоровья кожи, ногтей, роста волос и в целом для здоровья всего организма, включая функцию щитовидной железы.
Внешними проявлениями недостаточности рибофлавина у человека являются поражения слизистой оболочки губ с вертикальными трещинами и слущиванием эпителия (хейлоз), изъязвления в углах рта (ангулярный стоматит), отёк и покраснение языка (глоссит), себорейный дерматит на носогубной складке, крыльях носа, ушах, веках. Часто развиваются также изменения со стороны органов зрения: светобоязнь, васкуляризация роговой оболочки, конъюнктивит, кератит и в некоторых случаях — катаракта. В ряде случаев при авитаминозе имеют место анемия и нервные расстройства, проявляющиеся в мышечной слабости, жгучих болях в ногах и др.
Основные причины недостатка рибофлавина у человека — недостаточное потребление пищи, содержащей этот витамин; неправильное хранение и приготовление пищи, содержащей данный витамин, вследствие чего содержание витамина резко уменьшается; хронические заболевания желудочно-кишечного тракта, приём медикаментов, являющихся антагонистами рибофлавина.
| Продукт питания | Содержание рибофлавина, мг/100 г продукта: |
|---|---|
| печень и почки | 2,80—4,66 |
| дрожжи | 2,07—4,0 |
| яйца | 0,30—0,80 |
| миндаль | 0,80 |
| шампиньоны | 0,4 |
| белые грибы | 0,3 |
| лисички | 0,3 |
| творог | 0,30—0,50 |
| брокколи | 0,3 |
| белокочанная капуста | 0,25 |
| гречневая крупа | 0,24 |
| молоко | 0,13—0,18 |
| мясо | 0,15—0,17 |
| очищенный рис, макаронные изделия, белый хлеб, большинство фруктов и овощей | 0,03—0,05 |
Человеческий организм не накапливает рибофлавин, и любой избыток выводится вместе с мочой. При избытке рибофлавина моча окрашивается в ярко-жёлтый цвет.
Нормы потребления рибофлавина[править | править код]
| Пол | Возраст | Суточная норма рибофлавина (витамина B2)[2] |
|---|---|---|
| Младенцы | до 6 месяцев | 0,4 мг/день |
| Младенцы | 7 — 12 месяцев | 0,6 мг/день |
| Дети | 1 — 3 года | 0,9 мг/день |
| Дети | 4 — 8 лет | 1,3 мг/день |
| Дети | 9 — 13 лет | 1,9 (мальчики) 1,7 (девочки) мг/день |
| Мужчины | 14 лет и старше | 1,7 мг/день |
| Женщины | 14 лет и старше | 1,8 мг/день |
| Женщины | беременные кормящие | 2,0 мг/день 2,2 мг/день |
В пожилом возрасте и при усиленных физических нагрузках потребность возрастает.
Получение в промышленности[править | править код]
В промышленности рибофлавин получают химическим синтезом из 3,4-диметиланилина и рибозы или микробиологически, например, с использованием гриба Eremothecium ashbyi или используя генетически изменённые бактерии Bacillus subtilis.
Фармакологическое применение[править | править код]
Препараты рибофлавин и ФМН применяют для профилактики и лечения недостаточности витамина B2, при кожных заболеваниях, вяло заживающих ранах, заболеваниях глаз, нарушении функции желудочно-кишечного тракта, диабете, анемиях, циррозе печени.
Применение в пищевой промышленности[править | править код]
В пищевой промышленности рибофлавин используется для обогащения некоторых продуктов питания витамином B2 или как пищевой краситель (E101).
Рибофлавин зарегистрирован в качестве пищевой добавки Е101.
Синонимы[править | править код]
Лактофлавин, овофлавин, гепатофлавин, вердофлавин, урофлавин, бефлавин, бефлавит, бетавитам, флаваксин, флавитол, лактобен, рибовин, витафлавин, витаплекс В2. Большинство из этих названий указывают на источник, из которого данный витамин был исходно выделен, то есть молоко, яйца, печень, растения, моча.
Формы выпуска[править | править код]
Порошок; таблетки по 0,002 г в профилактических целях; таблетки по 0,005 и 0,01 г в лечебных целях. Ампулы 1 мл — раствор для внутримышечного введения.
Литература[править | править код]
- Н. С. Зефиров, Н. Н. Кулов и др. Химическая энциклопедия. Том 4. — Москва: Научное издательство «Большая российская энциклопедия», 1995. — С. 266—267. — ISBN 5-85270-092-4
Примечания[править | править код]
- ↑ Т. Т. Березов. Биологическая химия / Под редакцией академика АМН СССР С. С. Дебова. — 2е, переработанное и дополненное.
- ↑ Riboflavin.
Источник
Витамин В2
(рибофлавин) впервые был выделен из молока и ряда других пищевых продуктов. В
зависимости от источника получения витамин В2 называли по-разному,
хотя по существу это было одно и то же соединение: лактофлавин (из молока),
гепатофлавин (из печени), овофлавин (из белка яиц), вердофлавин (из растений).
Химический синтез витамина В2 был осуществлен в 1935 г. Р. Куном.
Растворы витамина В2 имеют оранжево-желтую окраску и характеризуются
желто-зеленой флюоресценцией.
В основе
молекулы рибофлавина лежит гетероциклическое соединение изоаллоксазин
(сочетание бензольного, пиразинового и пиримидинового колец), к которому в
положении 9 присоединен пятиатомный спирт рибитол. Химическое название
«рибофлавин» отражает наличие рибитола и желтой окраски препарата ,
рациональное название его 6,7-диметил-9-D-рибитилизоаллоксазин.
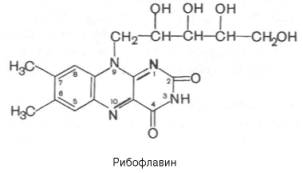
Рибофлавин
хорошо растворим в воде, устойчив в кислых растворах, но легко разрушается в
нейтральных и щелочных растворах. Он весьма чувствителен к видимому и
УФ-излучению и сравнительно легко подвергается обратимому восстановлению,
присоединяя водород по месту двойных связей и превращаясь в бесцветную
лейкоформу. Это свойство рибофлавина легко окисляться и восстанавливаться лежит
в основе его биологического действия в клеточном метаболизме.
Клинические
проявления недостаточности рибофлавина лучше всего изучены на экспериментальных
животных. Помимо остановки роста, выпадения волос (алопеция), характерных для
большинства авитаминозов, специфичными для авитаминоза В2 являются
воспалительные процессы слизистой оболочки языка (глоссит), губ, особенно у
углов рта, эпителия кожи и др. Наиболее характерны кератиты, воспалительные
процессы и усиленная васкуляризация роговой оболочки, катаракта (помутнение
хрусталика). При авитаминозе В2 у людей развиваются общая мышечная
слабость и слабость сердечной мышцы.
Согласно данным К. Яги, существует прямая связь между степенью недостаточности
рибофлавина у животных и накоплением в крови продуктов перекисного окисления
липидов (ПОЛ), развитием атеросклероза и катаракты. Эти нарушения, по мнению
автора, указывают на важную роль флавопротеинов в молекулярных механизмах
синтеза и распада продуктов ПОЛ.
Биологическая роль. Рибофлавин входит в состав флавиновых коферментов, в
частности ФМН и ФАД , являющихся в свою очередь просте-тическими группами
ферментов ряда других сложных белков – флаво-протеинов. Некоторые флавопротеины
в дополнение к ФМН или ФАД содержат еще прочно связанные неорганические ионы, в
частности железо или молибден, наделенные способностью катализировать транспорт
электронов. Различают 2 типа химических реакций, катализируемых этими
ферментами. К первому относятся реакции, в которых фермент осуществляет прямое
окисление с участием кислорода, т.е. дегидрирование (отщепление электронов и
протонов) исходного субстрата или промежуточного метаболита. К ферментам этой
группы относятся оксидазы L- и D-аминокислот, глициноксидаза, альдегидоксидаза,
ксантиноксидаза и др. Вторая группа реакций, катализируемых флавопротеинами,
характеризуется переносом электронов и протонов не от исходного субстрата, а от
восстановленных пиридиновых коферментов. Ферменты этой группы играют главную
роль в биологическом окислении. В каталитическом цикле изоаллоксазиновый
остаток ФАД или ФМН подвергается обратимому восстановлению с присоединением
электронов и атомов водорода к N1 и N10.
ФМН и ФАД прочно связываются с белковым компонентом, иногда даже
ковалентно, как, например, в молекуле сукцинатдегидрогеназы.
ФМН
синтезируется в организме животных из свободного рибофлавина и АТФ при участии
специфического фермента рибофлавинкиназы:
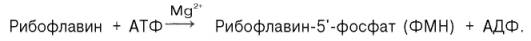
Образование
ФАД в тканях также протекает при участии специфического АТФ-зависимого фермента
ФМН-аденилилтрансферазы. Исходным веществом для синтеза является ФМН:
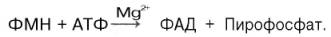
Распространение в природе и суточная потребность. Рибофлавин достаточно широко
распространен в природе. Он содержится почти во всех животных тканях и
растениях; сравнительно высокие концентрации его обнаружены в дрожжах. Из
пищевых продуктов рибофлавином богаты хлеб (из муки грубого помола), семена
злаков, яйца, молоко, мясо, свежие овощи и др.; в молоке он содержится в
свободном состоянии, а в печени и почках животных прочно связан с белками в
составе ФАД и ФМН. Из организма человека и животных рибофлавин выделяется с
мочой в свободном виде. Суточная потребность взрослого человека в рибофлавине
составляет 1,7 мг, в пожилом возрасте и при тяжелой физической работе эта
потребность возрастает.

Источник
| Тиамин | |
|---|---|
| Систематическое наименование | 3-[(4-амино-2-метил-5-пиримидил) метил]-5-(2-гидроксиэтил)-4-метил-тиазол |
| Хим. формула | C12H17N4OS+ |
| Рац. формула | C12H17N4OS |
| Молярная масса | 265,4 г/моль |
| Температура | |
| • плавления | 248—250 °C |
| Рег. номер CAS | 59-43-8 |
| PubChem | 1130 |
| SMILES | CC1=C(SC=[N+]1CC2=CN=C(N=C2N)C)CCO |
| InChI | 1S/C12H17N4OS/c1-8-11(3-4-17)18-7-16(8)6-10-5-14-9(2)15-12(10)13/h5,7,17H,3-4,6H2,1-2H3,(H2,13,14,15)/q+1 JZRWCGZRTZMZEH-UHFFFAOYSA-N |
| ChEBI | 18385 |
| ChemSpider | 1098 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Тиами́н (витамин B1; старое название — аневрин) — органическое гетероциклическое соединение, водорастворимый витамин, отвечающий формуле C12H17N4OS. Бесцветное кристаллическое вещество, хорошо растворимое в воде, нерастворимое в спирте (есть и жирорастворимый аналог витамина В1 (тиамина) — бенфотиамин). Водные растворы тиамина в кислой среде выдерживают нагревание до высоких температур без снижения биологической активности. В нейтральной и особенно в щелочной среде витамин B1 , наоборот, быстро разрушается при нагревании.[1] На сегодняшний день известно четыре формы тиамина в организме человека: нефосфорилированный тиамин, тиаминмонофосфат, тиаминдифосфат и тиаминтрифосфат. Тиаминдифосфат является самой распространенной формой тиамина.
Более известный как витамин B1, тиамин играет важную роль в процессах метаболизма углеводов, жиров и белков.
Тело человека может хранить до 30 мг тиамина в тканях.
Тиамин в основном сосредоточен в скелетных мышцах.
Другие органы, в которых он найден, — это мозг, сердце, печень и почки.
Вещество необходимо для нормального роста и развития и помогает поддерживать надлежащую работу сердца, нервной и пищеварительной систем.
Тиамин, являясь водорастворимым соединением, не запасается в организме и не обладает отравляющими свойствами.
Недостаток тиамина, возникающий при плохом питании и чрезмерном употреблении алкоголя, приводит к синдрому Вернике — Корсакова и авитаминозу.
Эти расстройства характеризуются неисправностями в нервной системе, которые могут быть восстановлены при высоком уровне потребления тиамина и соответствующей диете.
История[править | править код]
Христиан Эйкман предположил существование паралитического яда в эндосперме риса и наличие полезных для организма веществ в рисовых отрубях, излечивающих болезнь бери-бери. За исследования, которые привели к открытию витаминов, Эйкман получил в 1929 году Нобелевскую премию в области медицины. В 1911 году Казимир Функ получил биологически активное вещество из рисовых отрубей, которое назвал витамином, так как его молекула содержала азот.
В чистом виде впервые выделен Б. Янсеном в 1926 году.
Впервые в СССР был получен синтетический (искусственный) витамин В1 в пробирке лаборанта Королёвой Марии Ивановны в 1946 году на московском экспериментальном витаминном заводе. За получение витамина В1 лаборант Королёва М. И. была повышена в должности до «Химик» с внесением благодарности в личное дело. Это был второй в СССР после витамина С синтетический витамин, выпуск которого освоен витаминной промышленностью.
Физико-химические свойства[править | править код]
Тиамин хорошо растворим в воде. В кислых водных растворах весьма устойчив к нагреванию, в щелочных — быстро разрушается.[источник не указан 1619 дней]
Молекула содержит два соединённых метиленовой связью кольца: пиримидиновое и тиазоловое.
Метаболическая роль и обмен[править | править код]
В природе тиамин синтезируется растениями и многими микроорганизмами. Большинство животных и человек не могут синтезировать тиамин и получают его вместе с пищей. В тиамине нуждаются все животные за исключением жвачных, так как бактерии в их кишечнике синтезируют достаточное количество витамина.
Всасываясь из кишечника, тиамин фосфорилируется и превращается в тиаминпирофосфат.
Тиаминпирофосфат (ТПФ) — активная форма тиамина — является коферментом пируватдекарбоксилазного и α-кетоглутаратдегидрогеназного комплексов, а также транскетолазы.
Первые два фермента участвуют в метаболизме углеводов, транскетолаза функционирует в пентозофосфатном пути, участвуя в переносе гликоальдегидного радикала между кето- и альдосахарами. ТПФ синтезируется ферментом тиаминпирофосфокиназой, главным образом в печени и в ткани мозга. Реакция требует присутствия свободного тиамина, ионов Mg2+ и АТФ. Также ТПФ выступает коферментом дегидрогеназы γ-оксиглутаровой кислоты и пируватдекарбоксилазы клеток дрожжей.
Другими производными тиамина являются:
- Тиаминтрифосфат, обнаружен у бактерий, грибов, растений и животных[2], у E. coli играет роль сигнальной молекулы при ответе на аминокислотное голодание[3].
- Аденозинтиаминдифосфат — накапливается у E. coli в результате углеродного голодания[4].
- Аденозинтиаминтрифосфат — присутствует в небольших количествах в печени позвоночных, функция его неизвестна[5].
Недостаток[править | править код]
Системный недостаток тиамина является причиной развития ряда тяжёлых расстройств, ведущее место в которых занимают поражения нервной системы. Комплекс последствий недостаточности тиамина известен под названием болезни бери-бери и синдрома Корсакова-Вернике.
Как правило, развитие дефицита тиамина бывает связано с нарушениями в питании. Это может быть следствием недостаточного поступления тиамина с пищей либо происходить в результате избыточного употребления продуктов, содержащих значительные количества антитиаминовых факторов. Так, свежие рыба и морепродукты содержат значительные количества тиаминазы, разрушающей витамин; чай и кофе ингибируют всасывание тиамина.
При бери-бери наблюдаются слабость, потеря веса, атрофия мышц, невриты, нарушения умственной деятельности, расстройства со стороны пищеварительной и сердечно-сосудистой системы, развитие парезов и параличей.
Одной из форм бери-бери, встречающейся преимущественно в развитых странах, является Синдром Гайе — Вернике (иначе — синдром Вернике — Корсакова), развивающийся при алкоголизме.
Синдром Вернике — Корсакова является потенциально фатальным неврологическим расстройством, что наиболее часто встречается у алкоголиков.
Алкоголь напрямую влияет на механизмы фосфорилирования/дефосфорилирования тиамина, что приводит к сильному уменьшению концентрации активной формы тиамина.
Энцефалопатия Вернике и Корсаковский психоз — два отдельных диагноза. Этот синдром вызывает повреждения головного мозга в третьем и четвёртом желудочке, таламусе и маммилярных органах. Развитие болезни приводит к психозу и необратимому повреждению в областях мозга, связанных с памятью. Симптомы энцефалопатии Корсакова-Вернике включают:
- путаницу и потерю умственной деятельности, что может прогрессировать до комы;
- потерю мышечной координации (атаксию);
- аномальные движения глаз, двоение в глазах;
- неспособность сформировать новые воспоминания;
- потерю памяти.
Лечение энцефалопатии Вернике включает внутривенное введение тиамина в течение 3—5 дней с последующим приемом высокой потенции B-витаминного комплекса, пока улучшение продолжается.
При нарушении обмена тиамина в первую очередь возникает расстройство окислительного декарбоксилирования α-кетокислот и частично блокируется метаболизм углеводов. У больных бери-бери происходит накопление недоокисленных продуктов обмена пирувата, которые оказывают токсическое действие на ЦНС и обусловливают развитие метаболического ацидоза. Вследствие развития энергодефицита снижается эффективность работы ионных градиентных насосов, в том числе клеток нервной и мышечной ткани. Нарушается синтез жирных кислот и трансформация углеводов в жиры. Усиление катаболизма белков ведёт к развитию мышечной атрофии, у детей — к задержке физического развития. Вследствие затруднения образования из пировиноградной кислоты ацетил КоА страдает процесс ацетилирования холина.
Экспериментальные исследования по депривации тиамина у мышей приводили к энергодифециту в печени, увеличению уровня лактата, уменьшению транскриции генов, связанных с метаболизмом липидов и глюкозы[6].
Гипервитаминоз[править | править код]
Гипервитаминоз для тиамина встречается крайне редко. Парентеральное введение витамина B1 в большой дозе может вызвать анафилактический шок вследствие способности тиамина вызывать неспецифическую дегрануляцию тучных клеток.Тиамин в фармакологических дозах (от 30 мг) в таблетках угнетает холинэстеразу и гистаминазу[источник не указан 649 дней], вызывая соответствующие синдромы. Также вызывает дефицит меди, витаминов B2 и B3 в крови[источник не указан 649 дней]. Леводопа постепенно вызывает гипервитаминоз B1[источник не указан 649 дней] (возможно именно поэтому сначала идёт улучшение от леводопы, а потом — ранее необъяснимое ухудшение.)
При фотодерматозах и СКВ регистрируется всегда повышенный фон B1 и дефицит B6, особенно после загара.
Распространение в пищевых продуктах[править | править код]
Основные количества тиамина человек получает с растительной пищей. Богаты тиамином такая растительная еда, как пшеничный хлеб из муки грубого помола, соя, фасоль, горох, шпинат. Меньше содержание тиамина в картофеле, моркови, капусте. Из животной пищи содержанием тиамина выделяются печень, почки, мозг, свинина, говядина, также он содержится в дрожжах. В молоке его содержится около 0,5 мг/кг.[7] Витамин B1 синтезируется некоторыми видами бактерий, составляющих микрофлору толстого кишечника.
Нормы потребления тиамина (витамина B1)[править | править код]
| Пол | Возраст | Суточная норма тиамина (витамин B1)[8], мг/день |
|---|---|---|
| Младенцы | до 6 месяцев | 0,2 |
| Младенцы | 7 — 12 месяцев | 0,3 |
| Дети | 1 — 3 года | 0,5 |
| Дети | 4 — 8 лет | 0,6 |
| Дети | 9 — 13 лет | 0,9 |
| Мужчины | 14 лет и старше | 1,2 |
| Женщины | 14-18 лет | 1,0 |
| Женщины | 19 лет и старше | 1,1 |
Формы выпуска[править | править код]
- таблетки 2 мг, 5 мг, 10 мг (тиамина хлорид);
- таблетки 2,58 мг, 6,45 мг, 12,9 мг (тиамина бромид);
- таблетки 100 мг, покрытые оболочкой (тиамина хлорид);
- капсулы 100 мг
Примечания[править | править код]
- ↑ Б.Ф.Коровкин. Биологическая
химия. — 1998. - ↑ Makarchikov A. F., Lakaye B., Gulyai I. E., Czerniecki J., Coumans B., Wins P., Grisar T and Bettendorff L. Thiamine triphosphate and thiamine triphosphatase activities: from bacteria to mammals (англ.) // Cell. Mol. Life Sci : journal. — 2003. — Vol. 60. — P. 1477—1488. — doi:10.1007/s00018-003-3098-4.
- ↑ Lakaye B., Wirtzfeld B., Wins P., Grisar T and Bettendorff L. Thiamine triphosphate, a new signal required for optimal growth of Escherichia coli during amino acid starvation (англ.) // J. Biol. Chem. : journal. — 2004. — Vol. 279. — P. 17142—17147. — doi:10.1074/jbc.M313569200. — PMID 14769791.
- ↑ Bettendorff L., Wirtzfeld B., Makarchikov A. F., Mazzucchelli G., Frédérich M., Gigliobianco T., Gangolf M., De Pauw E., Angenot L and Wins P. Discovery of a natural thiamine adenine nucleotide (неопр.) // Nature Chem. Biol.. — 2007. — Т. 3. — С. 211—212. — doi:10.1038/nchembio867.
- ↑ Frédérich M., Delvaux D., Gigliobianco T., Gangolf M., Dive G., Mazzucchelli G., Elias B., De Pauw E., Angenot L., Wins P. and Bettendorff L. Thiaminylated adenine nucleotides — chemical synthesis, structural characterization and natural occurrence FEBS J. (англ.) : journal. — 2009. — Vol. 276. — P. 3256—3268. — doi:10.1111/j.1742-4658.2009.07040.x.
- ↑ Alain de J. Hernandez-Vazquez, Josue Andres Garcia-Sanchez, Elizabeth Moreno-Arriola, Ana Salvador-Adriano, Daniel Ortega-Cuellar. Thiamine Deprivation Produces a Liver ATP Deficit and Metabolic and Genomic Effects in Mice: Findings Are Parallel to Those of Biotin Deficiency and Have Implications for Energy Disorders // Journal of Nutrigenetics and Nutrigenomics. — 2017-02-18. — Т. 9, вып. 5—6. — С. 287—299. — ISSN 1661-6758. — doi:10.1159/000456663.
- ↑ Источники витамина В1. В каких продуктах содержится витамин B1 (недоступная ссылка). Дата обращения 12 декабря 2010. Архивировано 24 ноября 2010 года.
- ↑ Thiamin.
Источник
