Циклопентанпергидрофенантрен в основе какого витамина

Производные циклопентанпергидрофенантрена (стероиды).
Производные этого класса широко представлены как биологически активные вещества, они являются незаменимыми фрагментами биологических обменных процессов в живом организме.
Структура стероидных гормонов – естественных метаболитов, выполняющих регуляторные функции в организме, включает циклопентановые и циклогексановые фрагменты. Гормоны стероидного типа, в отличие от пептидных гормонов могут проникать в клетку в виде комплекса с рецептором и воздействовать на клеточное ядро и синтез нуклеиновых кислот.
Особенность одного из представителей стероидов – холестерина является его участие в строении клеточной мембраны, которая состоит из фосфолипидных молекул, триглицеридов, жирных кислот и холестерина – именно наличием холестерина отличаются клетки эукариоты (животные клетки), от клеток прокариотов (микробные клетки).
Принято делить все производные циклопентанпергидрофенантрена на следующие классы:
1.Стероиды:
1.1.Гестагены;
1.2.Кортикостероиды;
1.3.Андрогены;
1.4.Эстрогены.
2.Сердечные гликозиды.
3.Анаболики.
4.Витамины группы D.
Общую структуру циклопентанпергидрофенантрена принято изображать следующим образом:

Вещества, содержащие эту циклическую структуру называют стеринами. По их происхождению, стерины принято подразделять:
1.Зоостерины – С27;Главным образом это холестерин. Содержатся в клетках животного происхождения.
2.Фитостерины –С28-29; Основной представитель – эргостерин. Фитостерины выделяют обычно из растительного сырья.
3.Микостерины. Стероиды, содержащиеся в клеточной стенке грибов.
Особое место среди стероидов занимают витамины группы D. Распространение и свойства. Витамин D встречается в печени разных рыб, им очень богат рыбий жир. Если пища бедна витамином D, возникает предрасположение к заболеванию рахитом. Рахит — авитаминоз детского возраста, хроническое заболевание всего организма, вызываемое расстройством солевого обмена, главным образом фосфора и кальция, в результате чего получается недостаточное отложение извести в растущих костях и неправильное их развитие.
Большое влияние на содержание витамина D в растительных и животных жирах имеет облучение ультрафиолетовыми лучами. Так, например, прованское и хлопковое масло, молоко, как свежее, так и консервированное, при получасовом облучении кварцевой лампой приобретают такие же свойства, как свежий рыбий жир. Овощи, выращиваемые в парниках, содержат меньше витамина D, чем овощи, выращиваемые на огороде, так как стекла парниковых рам не пропускают этих лучей. Отсюда понятно благоприятное влияние солнечного света на детей, больных рахитом.
Химическая природа. Доказано, что витамин D содержится в неомыляемой части рыбьего жира, куда входят так называемые стерины. Стеринами называются весьма распространенные в растительном (фитостерины) и животном (зоостерины) мире высокомолекулярные спирты, важные в физиологическом отношении, без них невозможно развитие живых клеток. Установлено, что они содержатся во всех органах, главным образом в мозговом веществе и нервной ткани. Наиболее изучен холестерин.

Холестерин был выделен из неомыляемой части рыбьего жира, который при облучении ультрафиолетовыми лучами приобретает свойства витамина D. Когда опыт был проделан с чистым препаратом холестерина, то последний свойств витамина D не получил; было установлено, что не холестерин, а что-то сопутствующее ему и удаляемое при очистке обладает способностью при облучении приобретать свойства витамина D. Вскоре был выделен часто сопутствующий холестерину эргостерин. Оказалось, что именно он приобретает свойства витамина D2 после облучения. Установлено, что для получения из холестерина активного продукта необходимо до облучения его предварительно дегидрировать. Эргостерин считают провитамином D2, а холестерин —провитамином D3. Эргостерин впервые был выделен из спорыньи; его можно изолировать также из дрожжей. Эргостерин по составу и строению, как видно из формулы близок к холестерину:

Эргостерин является провитамином D. Получают его экстракцией из дрожжей. Наиболее дешевым является мицеллий в производстве пенициллина, содержащий до 0,5% смеси стеринов. В последние годы источником стероидов служат также и растительные объекты, в частности разработаны методы получения ситолстеринов из продукции лесохимии, которая в настоящее время практически исчезла в России.
Механизм образования кальциферолов (витаминов группы D) основан на фотохимических процессах природных стеринов (эргостерин, холестерин, ситостерин и др.).
При фотолизе эргостерина происходит пространственная изомеризация при атоме С-10 и образуется люмистерин. Процесс фотолиза достаточно капризный, т.к. в молекуле имеется несколько оптически активных центров:

Дальнейший фотолиз в более жестких условиях приводит к разрыву связи С-9-С-10 и образованию тахистерина с одновременной перегруппировкой двойных связей и, наконец, к образованию эргокальциферола, имеющего экзоциклическую двойную связь:

Выход продукта сильно зависит от условий реакции: частота УФ освещения, продолжительность, растворитель и т.д. Процесс получения эргокальциферола из тахистерина может быть проведен термолизом, правда больше осмоление. При неконтролируемом фотолизе возможно образование токсичных продуктов, таких как токсистерин и супрастерин. В получаемых эргокальциферолах кольца А и С соединены между собой этиленовым мостиком с двумя экзоциклическими двойными связями, обуславливающими цис-транс-изомерию. Природные кальциферолы имеют транс-конфигурацию.
Эргокальциферол-Ergocalciferol-Витамин D2

24-метил-9,10-холеста-5.7,10(19),22-тетраен-3β-ол
Свойства. Белый кристаллический порошок без запаха. Неустойчив по отношению к кислороду воздуха и свету. Т.пл. 115-118°C. Удельное вращение от + 103 до + 108° (15%-ный раствор в абсолютном этаноле).
Получение. Эргокальциферол в промышленности получают полусинтетическим путем из природных стеринов. Полный синтез осуществляется из нафталина или тетралина надстраиванием циклов, однако он очень сложен и затратен. Исходным веществом служит эргостерин:

Производные эргокальциферола практически нерастворимы в воде, легко растворимы или растворимы в этаноле, мало и медленно (эргокальциферол и дигидротахистерол умеренно) в растительных маслах и очень легко в хлороформе.
Подлинность.
1.Подлинность эргокальциферола, используя ГСО, подтверждают по ИК-спектру в области 3500-700 см-1.
2.Испытания на подлинность по МФ и ФСП выполняют, получая УФ спектр этанольных растворов в области 230-300 нм. Должно присутствовать максимум поглощения при 265 нм.
3.Реактивом для обнаружения эргокальциферола служит хлорид сурьмы (Ш). Образуется оранжевое окрашивание. Химизм реакции основан на образовании комплекса с переносом заряда по двойной связи.
4.При добавлении к раствору эргокальциферола 2% раствора хлористого ацетила образуется оранжево-красное окрашивание. Реакцию используют для фотометрического определения эргокальциферола в драже (при длине волны 500 нм).
5.При взаимодействии в среде безводного пиридина с 3,5-динитробензоилхлоридом эргокальциферол на водяной бане дает соответствующий бензоат с т.пл. 148°C и удельным вращением +58° (1%-ный раствор в бензоле).
6.С бензольным раствором оксихинолината ванадия эргокальциферол дает переход при 60°C с серо-зеленой окраски до красной.
7.ВЭЖХ.
Чистота и примеси. Испытания проводят на микробиологическую чистоту.
Методом ТСХ на наличие посторонних примесей. Эргокальциферол проверяют на наличие исходных веществ: эргостерина и группы восстанавливающих веществ, на вещества подобные тахистерину. Контролируют также остаточные растворители, возникающие к процессе синтеза.
Количественное определение.
1.УФ спектрофотометрия (265 нм).
2.Колориметрия (500 нм).
3.ВЭЖХ в сравнении со стандартным образцом.
Формы выпуска. Драже по 12,5 мкг; 0,5% масляный раствор во флаконах по 5 мл; 0,125% масляный раствор во флаконах по 10 мл;
Применение. Витамины группы D регулируют обмен фосфора и кальция в организме. Эргокальциферол-эффективное средство для профилактики и лечения заболеваний кожи и слизистых оболочек, их применяют при рахите, некоторых формах туберкулеза и др.
Холекальциферол-Колекальцтферол-Colecalciferol-Витамин D3

9,10-секохолеста-5,7,10(19)-триен-3β-ол.
Свойства. Бесцветные кристаллы, нерастворимые в воде. Т.пл.84-86°C, удельное вращение от +105 до +112°. Малоустойчив к действию света, легко окисляется.
Получение. Получают аналогично эргокальциферолу из холестерина. Другим источником получения являются дрожжи.
Подлинность и количественное определение аналогично эргокальциферолу.
Формы выпуска. Масляный раствор 0,5 мг в 1 мл, таблетки 0,025 мг. Применяют внутрь и внутримышечно. Синоним Вигантол (ФРГ).
Применение. Для лечения и профилактики рахита,спазмофилия, остеомаляция.
Дигидротахистерол-Dihydrosterol

(5Е, 7Е, 22Е)-(3S,10S)-9,10-секоэргоста-5,7,22-триен-3β-ол
Свойства. Белые кристаллы или белый кристаллический порошок без запаха. Т.пл. 125-132 °C или 112-114°C. Удельное вращение от +100 до +103°(2%-ный раствор в этаноле).
Получение. Получают фотохимической изомеризацией из цис– тахистерина:

Подлинность.
1.ИК спектр в области 2000-800 см-1.
2.УФ спектр препарат имеет три максимума при 242,5; 251 и 260,5 нм.
3.Раствор хлорида сурьмы (III) вместе с 2% раствора ацетилхлорида используют для идентификации дигидротахистерола; пос-ле нагревания на водяной бане появляется красное окрашивание.
4.ТСХ.
Количественное определение.
1.УФ спектрофотометрия при 251 нм.
2.ВЭЖХ.
Посторонние примеси. ВЭЖХ и ТСХ.
Формы выпуска. 0,15 раствор в масле для приема внутрь.
Применение. Лечение и профилактика рахита.
Альфакальцидол-Alfacalcidol

9,10-секохолестатриен-5Z,7Е,10(19)-диол-1α,3β
Свойства. Бесцветные кристаллы или белый кристаллической порошок. Неустойчив по отношению к свету и кислороду воздуха. Т.пл. 137-144°C.
Получение.

Подлинность.
1.ИК спектр.
2.УФ спектр. Имеет максимум поглощения при 265 нм.
3.ТСХ.
Количественное определение.
1.УФ спектрофотометрия.
2.ВЭЖХ.
Форма выпуска. Капсулы по 0,001; 0,0005; 0,00025 г; раствор в масле 0,0009%.
Применение. Аналогично всем витаминам группы D.
Карденолиды (гликозиды сердечного действия).
Пo химической структуре сердечные, как и другие, гликозиды представляют собой эфиры, в молекулах которых гликозидной связью связаны между собой агликон и остатки моно-, ди-, три- или тетрасахарида. У некоторых первичных гликозидов к сахарному компоненту присоединен остаток уксусной кислоты. Сахара, входящие в состав сердечных гликозидов, за исключением глюкозы и рамнозы, специфичны для данной группы веществ и представляют собой 6-дезоксигексозы или их 3-О-метиловые эфиры. Из сердечных гликозидов выделено более 50 углеводов. Важнейшими моносахаридами, входящими в состав сердечных гликозидов, являются:

Агликоны (генины) сердечных гликозидов имеют стероидную структуру, т. е. являются производными циклопентанпергидрофенантрена. Они представляют собой ненасыщенные стероидные лактоны. По химическому строению агликоны можно разделить на две группы, отличающиеся структурой присоединенного в положении 17 лактонного цикла, который обычно занимает β-конфигурацию. Пятичленный лактонный цикл входит в структуру агликонов карденолидов, а шестичленный — буфадиенолидов. В отличие от большинства других стероидов кольца С и D в карденолидах и буфадиенолидах имеют цис-сочленение, а кольца А и В могут иметь как цис- так и транс-сочленение. Кольца В и С всегда имеют транс-сочленение. Общие формулы этих групп гликозидов:

В стероидной части молекулы могут также быть кето-, ацильные, эпоксигруппы, изолированные С=С связи.
Карденолиды содержатся в различных видах наперстянки, строфанта, ландыша, желтушника, олеандра, горицвета весеннего и др. Буфадиенолиды входят в состав морозника, морского лука, а также найдены у животных (жабы).
Между химической структурой и фармакологическим действием сердечных гликозидов существует определенная взаимосвязь. Носителем биологической активности является агликон. Сахарный компонент, присоединенный в положении 3 к агликону, влияет на скорость всасывания, а следовательно, на продолжительность действия. Чем больше остатков моносахаридов в молекуле гликозида, тем активнее он действует.
Специфическое действие гликозида на сердце (замедление частоты и усиление сердечных сокращений) обусловлено наличием в молекуле агликона пяти- или шестичленного лактонного цикла, присоединенного в положении 17, и гидроксила в положении 14. На кардиотоническое действие большое влияние оказывает заместитель в положении 10. Большая часть агликонов в этом положении имеет метильную или альдегидную группу. Окисление альдегидной группы до карбоксильной значительно ослабляет действие на сердечную мышцу. Замена стероидного цикла агликонов производными бензола, нафталина, так же как замена лактонного цикла другими радикалами и даже изменение характера связи между стероидным ядром и лактоном, приводит к потере фармакологической активности.
Большинство сердечных гликозидов по химическому строению представляют собой карденолиды. Их агликоны имеют общую формулу и отличаются друг от друга радикалами R, Х1,Х2,Х3:

Агликон | Радикал | |||
R | Х1 | Х2 | Х3 | |
Дигитоксигенин | -СН3 | – | – | – |
Гитоксигенин | -СН3 | -ОН | – | – |
Дигоксигенин | -СН3 | – | -ОН | – |
Строфантидин | -СН=О | – | – | -ОН |
Вторичные гликозиды обоих видов наперстянок после потери указанных продуктов гидролиза состоят из агликонов и сахарной части, причем последняя у всех трех вторичных гликозидов одинакова.
Формула дигитоксина:

Вторичные гликозиды наперстянки пурпуровой и наперстянки шерстистой — дигитоксин и дигоксин применяют в виде индивидуальных лекарственных веществ.
Формула дигоксина:
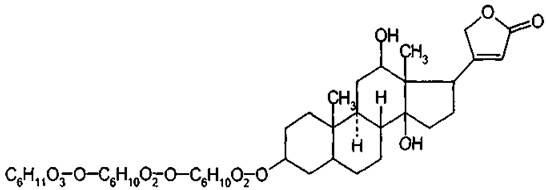
Строфантин К содержит в основном два гликозида, состав которых приведен в таблице.

К-строфантин-β можно рассматривать как вторичный гликозид К-строфантозида, который теряя молекулу глюкозы превращается в К-строфантин-β.
Формула К-строфантозида:

Применяемый при приготовлении раствора строфантина для инъекций строфантин К представляет собой смесь сердечных гликозидов (ФС). Коргликон в соответствии с требованиями ФС также представляет собой сумму не менее пяти гликозидов, получаемую из листьев ландыша майского и применяемую для приготовления раствора коргликона для инъекций. Основным гликозидом, содержащимся в листьях ландыша майского, является конваллятоксин. Он включает конваллятоксигенин (идентичный строфантидину) и сахарный компонент L-рамнозу.
Синтез некоторых сердечных гликозидов хотя и осуществлён, но из-за многостадийности и низкого выхода практического применения не получил. Поэтому единственным, имеющим более чем столетнюю историю, промышленным источником получения сердечных гликозидов является растительное сырье. Процесс выделения очень сложен, так как в растении содержатся ферменты, способные необратимо изменить химическую структуру гликозидов. Такие изменения могут также произойти под влиянием света, температуры и т. д. Методы получения отличаются большим разнообразием.
В растении обычно содержится несколько сердечных гликозидов и целый ряд сопутствующих веществ. Общая схема получения сердечных гликозидов заключается в предварительном обезжиривании растительного сырья с помощью эфира или лигроина. Для экстракции гликозидов из растений используют в зависимости от их растворимости ацетон, спирты, этилацетат, часто с добавлением в них воды. Затем сырье настаивают с 70%-ным этиловым спиртом для удаления хлорофилла. Спирт отгоняют под вакуумом и из остатка извлекают первичные гликозиды теплой водой, вторично настаивая несколько дней. Из полученной смеси неочищенных гликозидов удаляют смолы (эфиром) и сапонины (раствором ацетата свинца). Для этой цели используют также адсорбцию примесей на оксиде алюминия. Гликозиды осаждают, насыщая смесь водным раствором сульфата аммония. Разделение смеси гликозидов основано на различии их растворимости в органических растворителях. Для разделения используют хроматографические методы или противоточное распределение веществ в специально подобранных системах растворителей.
Свойства. Основные свойства сердечных гликозидов представлены в таблице.

Подлинность. Для индивидуальных гликозидов – дигоксина и дигитоксина рекомендован метод ИК в таблетках с КВг в ирнтервале от 4500 до 400 см-1.
Для установления подлинности сердечных гликозидов могут быть использованы общие химические реакции. Первая группа реакций обнгаруживает стероидный фрагмент молеклы гликозида.
1.Реакция Либермана-Бурхардта. Она основана на способности стероидов к дегидратации под действием уксусного ангидрида и концентрированной серной кислоты. В результате реакции слой уксусного ангидрида окрашивается в зеленый цвет. ФС рекомендует эту реакцию для установления подлинности коргликона и строфантина К.
2.Флуориметрический метод – дает зеленую флуоресценцию со смесью фосфорной и серной кислот с хлорным железом, или перхлоратом железа в серной кислоте.
Реакции на лактонный цикл.
1.Реакция Легаля – исчезающее красное окрашивание при обработке нитропруссидом натрия в щелочной среде.
2.Реакция Балье – прибавление щелочного раствора пикриновой кислоты (оранжево-красное окрашивание).

3.Реакция Раймонда. Взаимодействие в щелочной среде гликозидов с метадинитробензолом (красно-фиолетовое окрашивание).
Реакции на гликозидный фрагмент молекулы.
1.Восстановительные реакции. Для этой цели могут быть использованы свойственные сахарам реакции, основанные на их восстановительных свойствах (реакция с реактивом Фелинга, реакция «серебряного зеркала» и др.).
2.Реакция Келлера-Килиани. Из различных способов ФС рекомендует методику, заключающуюся в предварительном растворении 1-2 мг гликозида в ледяной уксусной кислоте, содержащей 0,05%-ного хлорида железа (III). Раствор осторожно вливают в пробирку с концентрированной серной кислотой и наблюдают окраску верхнего слоя, подтверждающую наличие в молекуле сахара — дигитоксозы (сине-зеленый цвет) и наличие агликона — дигитоксигенина по окраске на границе двух слоев (лилово-красной или бурой). Этим способом устанавливают подлинность дигитоксина.
Подлинность сердечных гликозидов определяют методом ТСХ, имеются примеры использования УФ-спектрофтометрии.
Применяются методы фотометрии и ВЭЖХ.
Количественное определение.
1.ВЭЖХ ( для строфантина К, дигоксина).
2.Биологические методы КЕД (кошачьи единицы действия); ГЕД (голубиные единицы действия); ЛЕД (лягушачью единицы действия).
3.Полярографические методы.
Формы выпуска препаратов.
Дигитоксин- таблетки 0,0001; суппозитории 0,00015 г. Применение:хроническая сердечная недостаточность с нарушением кровообращения. Список А.
Дигоксин – таблетки 0,00025 г; 0,0001 г; 0,1% раствор в ампулах для инъекций; Применение: Застойная недостаточность кровообращения. Подготовка к операциям на сердце. Хранение Список А.
Коргликон- очищенный препарат из листьев ландыша майского. Содержит сумму гликозидов с активностью в 1 мл 11-16 ЛЕД. Раствор для инъекций 0,06% в ампулах по 1 мл. Применение. Острая сердечно-сосудистая недостаточность. Отек легких. Список Б.
Строфантин К. Смесь сердечных гликозидо из семян строфанта Комбе. Раствор 0,025% и 0,05% в ампулах по 1 мл. Применение. Острая сердечная недостаточность. Пароксизмальная тахикардия. Список А.
Источник
